
| A. | 已知2SO2(g)+O2?2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol-1,则任何酸碱中和的反应热均为57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2;则△H1<△H2 |
分析 A、依据化学反应是放热反应,反应物的总能量高于生成物的总能量;
B、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定;
C、在稀溶液中强酸和强碱反应生成1mol水放出的热量为中和热;
D、一氧化碳燃烧生成二氧化碳过程是放出热量.
解答 解:A、依据化学反应是放热反应,二氧化硫和氧气能量之和高于三氧化硫的能量,不能确定二氧化硫能量与三氧化硫的关系,故A错误;
B、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定,所以石墨比金刚石稳定,故B错误;
C、在稀溶液中强酸和强碱反应生成1mol水放出的热量为中和热,△H=-57.3kJ/mol,弱酸电离时吸热,所以放出的热量小于57.3kJ/mol,故C错误;
D、已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,所以△H1<△H2,故D正确;
故选D.
点评 本题考查了热化学方程式的书写方法,燃烧热,中和热概念分析应用,掌握概念实质是关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 8.3 | 10.7 | 4.0 |
| A. | 0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 | |
| B. | NaHCO3溶液中2c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| C. | NaHSO3溶液中c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向NaClO溶液中滴加硫酸至中性时,2c(SO42-)=c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
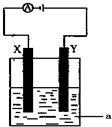 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物成分 | 提纯试剂 | 离子方程式 |
| ①FeCl2溶液(FeCl3) | ||
| ②FeCl3溶液(FeCl2) | ||
| ③Na2CO3溶液(NaHCO3) | ||
| ④Fe2O3(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的化合物中只含离子键 | |
| B. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴Ba(OH)2溶液,恰好使SO42-沉淀完全:2H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| D. | 过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
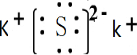 ,属于离子晶体.
,属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com