
| A. | Cu是氧化剂 | B. | H2SO4在反应中只表现氧化性 | ||
| C. | Cu在反应中被氧化 | D. | 1mol氧化剂在反应中得到1mol电子 |
分析 A、失电子的化合价升高的反应物是还原剂;
B、根据硫酸中元素化合价是否变化来分析;
C、铜是还原剂发生氧化反应被氧化;
D、硫由+6价变成+4价,所以1mol氧化剂在反应中得到2mol电子.
解答 解:A、失电子的化合价升高的反应物是还原剂,铜是还原剂,故A错误;
B、H2SO4中元素硫的化合价部分变化,所以硫酸既是氧化剂又是酸,故B错误;
C、铜是还原剂发生氧化反应,被氧化,故C正确;
D、硫由+6价变成+4价,所以1mol氧化剂在反应中得到2mol电子,故D错误;
故选C.
点评 本题以铜和浓硫酸的反应为载体考查了氧化还原反应,根据反应中元素化合价变化来分析解答,注意氧化还原反应的实质和特征的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

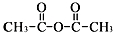
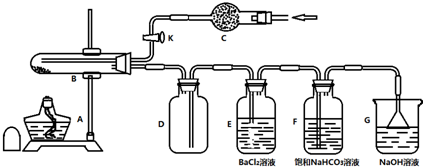
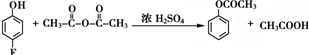 .
.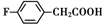 、
、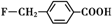
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
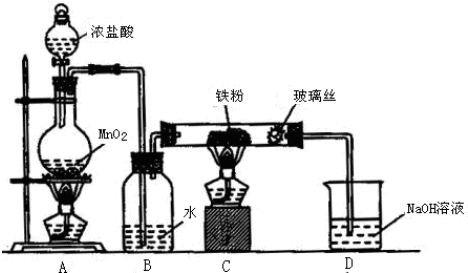
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(C2O42-)<0.64c(CO32-) | B. | c(CO32-)>1.56c(C2O42-) | ||
| C. | c(C2O42-)<1.56c(CO32-) | D. | c(C2O42-)>0.64c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
A.升高a的反应温度,乙醇的转化率增大
B.由b可知:乙醇的燃烧热为13.8 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(g) ΔH=+485.6 kJ·mol-1
D.制取等量的氢气,途径b消耗的能量更多
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com