
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
分析 甲苯和四氯化碳都不溶于水,且二者的密度不同,己烯含有碳碳双键,可发生加成、氧化反应,碘化钾、亚硫酸钠溶于水,具有还原性,根据物质的性质的异同选择合适的鉴别试剂.
解答 解:A.加入硝酸银溶液,不能鉴别甲苯和己烯,二者与硝酸银不反应,且密度都比水小不能鉴别,故A错误;
B.甲苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,加入溴水,色层位置不同,己烯与溴水发生加成反应,碘化钾与溴水发生氧化还原反应,溶液颜色加深,亚硫酸钠溶液与溴水发生氧化还原反应,溶液褪色,可鉴别,故B正确;
C.甲苯和己烯都与酸性高锰酸钾发生氧化还原反应,不能鉴别,故C错误;
D.氯化铁氧化鉴别碘化钾溶液、亚硫酸钠溶液,不能鉴别甲苯和己烯,故D错误.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及性质差异为解答的关键,注意反应现象相同时不能鉴别物质,侧重萃取及现象的考查,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
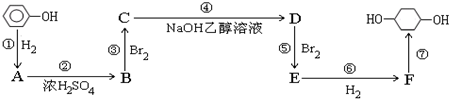
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;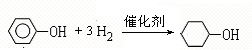 ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$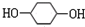 +2NaBr.
+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0020 | 0.0032 | 0.0040 | 0.0040 |
| A. | 前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1 | |
| B. | 达平衡时,至少需要从外界吸收的能量为0.968kJ | |
| C. | 增大c(H2O),可以提高水的分解率 | |
| D. | 使用纳米级Cu2O颗粒是为了提高催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
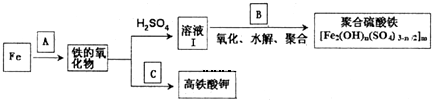
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com