
分析 配制的溶液中的钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量.
解答 解:在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,
故答案为:6.4mol;0.2mol.
点评 本题考查了物质的量的计算,题目难度中等,试题有利于培养学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
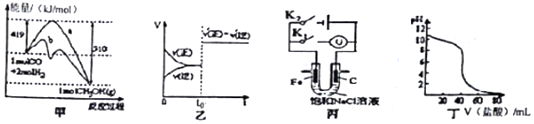
| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变快 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+﹑Ca2+﹑Cl-﹑CO32- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Cu2+﹑Cl-﹑Ca2+﹑NO3- | D. | NO3-﹑Na+﹑Ca2+﹑Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com