
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
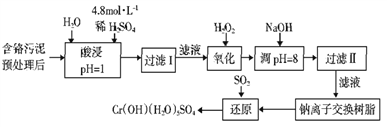
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_______ mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需_______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是_______。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是_______。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是_______。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是_______。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4。
【答案】 65.2 200mL容量瓶、胶头滴管 沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次。 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ 1,3,11,H2O,2,1
【解析】(1)质量分数为98%、密度为18.4g/cm3的浓硫酸的物质的量浓度=![]() =18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,由于没有200mL容量瓶,所以选择250mL容量瓶,所以18.4mol/L×V=4.8mol/L×0.25L,V=0.0652L=65.2mL;配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,使用的仪器为:量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶;故答案为:65.2;胶头滴管、250mL容量瓶;
=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,由于没有200mL容量瓶,所以选择250mL容量瓶,所以18.4mol/L×V=4.8mol/L×0.25L,V=0.0652L=65.2mL;配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,使用的仪器为:量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶;故答案为:65.2;胶头滴管、250mL容量瓶;
(2)过滤操作中洗涤沉淀的方法是沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次,故答案为:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次;
(3)双氧水具有氧化性,加入H2O2可以氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),也可以氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)溶液中存在的离子有:Fe3+、Al3+、Ca2+和Mg2+,根据表格数据,调节溶液的pH=8除去的杂质离子有Fe3+、Al3+,故答案为:Fe3+、Al3+;
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子有Ca2+、Mg2+,故答案为:Ca2+、Mg2+;
(6)根据氧化还原反应的规律,氧化还原反应须遵守得失电子守恒和质量守恒,方程式配平为:Na2Cr2O7+3SO2+11 H2O = 2Cr(OH)(H2O)5SO4+Na2SO4,故答案为:1,3,11,H2O,2,1。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21 。回答下列问题:
W | X | |||
Y | Z |
(1)X 在元素周期表中的位置为_______。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W的最简单氢化物的电子式为________________。
(4)W、Z 最高价氧化物的水化物酸性较强的为___________(填化学式)。
(5)Y单质与Fe2O3 反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为____________________。
(6)向盛有3 mL 鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为________________________________________。
(7)C3H7Z 的结构简式有____________________。
(8)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 在晶体中只要有阳离子就一定有阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是
① 容量瓶用蒸馏水洗涤但没有干燥
② 定容时仰视刻度线
③ 没有洗涤溶解NaCl固体的烧杯和玻璃棒
④ 称量NaCl固体时所用砝码生锈了
A. ①③ B. ②③ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚类化合物以其独特的化学结构使其拥有重要的生理活性,在农药、医药、化工、香料和染料等领域发挥着重要的作用。下图是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路线

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列问题
(1)B的结构简式为________,B分子中含有的官能团为________(填官能团名称)。
(2)反应③为取代反应,该反应的化学方程式为________。
(3)C的名称为________。
(4)A的结构简式为________,反应⑤的反应类型为________。
(5)B有多种同分异构体,其中与B含有相同官能团的同分异构体有________种。
(6)已知
参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com