
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼 | |
| B. | 明矾(KAl (SO4)2•12H2O)可用于净水 | |
| C. | 二者对应的氧化物均为碱性氧化物 | |
| D. | Fe3O4是一种红棕色粉末,俗称磁性氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN和HCN 1:1组成的溶液呈酸性 | |
| B. | 0.1mol•l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 | |
| C. | 根据两个反应即可得出这三种酸的电离常数数值 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的水解反应又叫做皂化反应 | |
| B. | 糖类都能发生水解反应 | |
| C. | 蛋白质发生变性后,生成氨基酸 | |
| D. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
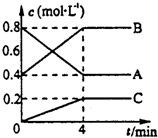 一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答:
一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | Y元素最高价氧化物对应的水化物的化学式为H3YO4 | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
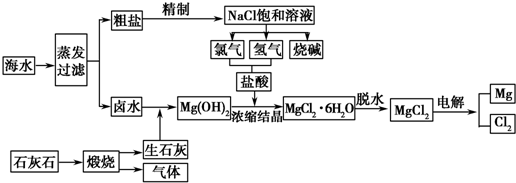
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com