

| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
分析 A.依据信息中化学键的断裂吸收的能量和形成化学键放出的热量分析判断;
B.依据化学键的键能以及可逆反应的热效应相反分析判断;
C.依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断;注意物质的聚集状态;
D.依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断.
解答 解:反应的焓变=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ,所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,
A.化学键的断裂吸收的能量和形成化学键放出的热量是化学反应中发生能量变化的主要原因,故A正确;
B.根据以上计算可知,氢气与氧气反应生成水是放热反应,所以水分解生成氢气跟氧气的同时吸收能量,故B正确;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,故C错误;
D.依据反应的热化学方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,可知同乘以2得到2H2(g)+O2(g)=2H2O(g)△H=-490KJ/mol,即:2molH2(g)跟1mol O2(g)反应生成2mol H2O(g)释放能量490kJ,故D正确;
故选C.
点评 本题考查了反应的热效应的计算依据和判断方法,题目难度中等,注意明确旧键断裂吸热热量,新键形成放出热量,要求学生能够依据化学键的键能来计算判断吸热反应和放热反应,即:反应的热效应=反应物的键能之和-生成物的键能之和.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
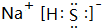 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com