
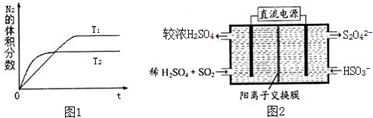
分析 (1)①根据“先拐先平数值大”原则判断的T1、T2大小,再根据平衡时氮气的体积分数判断温度对平衡的影响;
②利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数表达式计算;再根据反应速率和转化率定义计算;
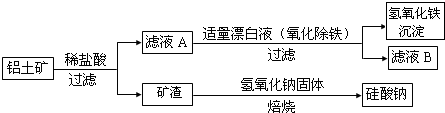
(2)①依据电极原理和反应过程中的离子变化写出电极反应;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,依据方程式即可解答;
(3)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
解答 解:(1)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应△H>0;
故答案为:>;
②令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
N2的反应速率=$\frac{1mol}{\frac{2L}{50s}}$=0.01 mol•L-1•s-1;
平衡常数$\frac{(\frac{2mol}{2L})^{2}}{\frac{9mol}{2L}×\frac{4mol}{2L}}$=$\frac{1}{9}$
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以$\frac{(\frac{2x}{2})^{2}}{\frac{1-x}{2}×\frac{1-x}{2}}$=$\frac{1}{9}$,解得x=$\frac{1}{7}$,
N2的转化率为$\frac{\frac{1}{7}mol}{1mol}$×100%=14.3%;
故答案为:0.01 mol•L-1•s-1,14.3%;
(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+;
故答案为:SO2+2H2O-2e-=SO42-+4H+;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,所以该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2;
(3)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{C(C{H}_{3}CO{O}^{-})×C({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7L/mol;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol;
故答案为:$\frac{2b}{a-2b}$×10-7L/mol.
点评 本题考查热化学方程式,化学平衡常数、化学平衡影响因素分析,原电池原理的分析应用,主要是弱电解质电离平衡常数的计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠和葡萄糖分别溶解在水中 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 食盐和冰分别受热熔化 | D. | 液溴和酒精分别挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非极性键也可存在于离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
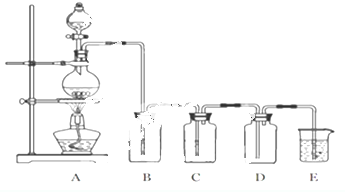
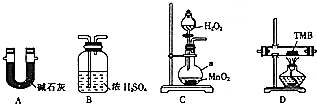 由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1CuSO4 溶液 | 将25.0gCuSO4•5H2O溶于蒸馏水配成100mL溶液 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液是否含有SO42- | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-二甲基-3-乙基丁烷 | B. | 2,2,3-三甲基戊烷 | ||
| C. | 2,2-二甲基-3-乙基丁烷 | D. | 3,4,4-三甲基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com