
分析 1)①二氧化硫雨氢氧化钙反应生成亚硫酸钙,加入硫酸,可生成硫酸钙和二氧化硫气体;
②可从原料价廉易得,SO2回收利用角度分析;
③加入适量的对苯二酚或对苯二胺等还原性物质,可防止亚硫酸盐被氧化;
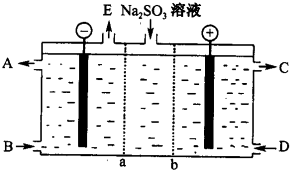
(2)①从C为硫酸可知,b为阴离子交换膜.故a为阳离子交换膜.在阴极区应为水放电生成氢气和氢氧根,故A为氢氧化钠,E为氢气;
②阳极应为亚硫酸根放电生成硫酸根.
解答 解:(1)①SO2与足量石灰水反应,生成亚硫酸钙和水,亚硫酸钙和硫酸反应生成硫酸钙、水和二氧化硫,发生的化学反应分别为SO2+Ca(OH)2=CaSO3↓+H2O、CaSO3+H2SO4=CaSO4+SO2↑+H2O,
故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;CaSO3+H2SO4=CaSO4+SO2↑+H2O;
②这种尾气处理方法的优点有:原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可返回作为原料,
股答案为:原料生石灰,硫酸价格便宜且容易获得;可得副产品石膏或SO2可作为生产化肥的原料;
③加入适量的对苯二酚或对苯二胺等还原性物质,可防止亚硫酸盐被氧化,不利于后期二氧化硫回收,故答案为:防止亚硫酸盐被氧化,不利于后期二氧化硫回收;
(2)①从C为硫酸可知,硫酸根来源于亚硫酸根放电.故b为阴离子交换膜,a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠,E为氢气,
故答案为:阳;NaOH溶液;氢气;
②阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,故答案为:SO32--2e-+H2O=2H++SO42-.
点评 本题考查酸雨的防治以及二氧化硫的性质,为高频考点,侧重于学生的分析能力的考查,题目涉及化学与技术及工业生产的考查,有利于培养学生良好的科学素养,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉长期暴露在空气中最后会变质失效 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | PM2.5是对空气中直径小于或等于2.5微米(2.5×10-6m)的固体颗粒或液滴的总称,其分散在空气中一定形成气溶胶 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起净水和杀菌消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

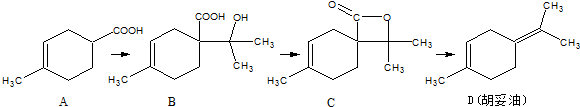
 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.
 或
或 (任写一个)
(任写一个)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ②③④⑥ | D. | ①②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸中:K+、MnO4-、CH3CH2OH | |
| B. | pH=10的溶液中:Na+、SO32-、NH3•H2O | |
| C. | 中性溶液中:Na+、NO3-、AlO2- | |
| D. | FeCl3溶液中:H2O2、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的自发过程都是熵值减小的过程 | |
| B. | 吸热的自发过程常常是熵值增加的过程 | |
| C. | 水自发地从高处流向低处,是趋向能量最低状态的倾向 | |
| D. | 只根据焓变来判断化学反应的方向是可以的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com