
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(一)(解析版) 题型:选择题
下列反应中,与乙醛生成乙酸属于同一种反应类型的是 ( )。
A.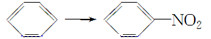
B.CH2=CHCl―→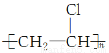
C.CH3CH2OH―→CH3CHO
D.CH3COOH―→CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:填空题
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42—。该溶液中c(H+)_________________________c(OH-)+c(SO42—)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第5练化学反应速率和化学平衡练习卷(解析版) 题型:选择题
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+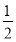 O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态
B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小
C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率
D.同一容器内同时发生反应①与②时,容器内温度可能保持不变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:填空题
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________________。

(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)XY2与H2O反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.氘原子中的质子数和中子数之比为1∶1
B.Na2O2、Na2O中均只含离子键
C.NH4Cl属于离子化合物,不含共价键
D.18 g重水(D2O)中含有的电子数为10 NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:选择题
已知:①H2O(g)=H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3
D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第2练氧化还原反应和离子反应练习卷(解析版) 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
(1)aTiO2+bCl2+cC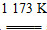 aTiCl4+cCO
aTiCl4+cCO
(2)TiCl4+2Mg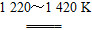 Ti+2MgCl2
Ti+2MgCl2
关于反应(1)、(2)的分析不正确的是
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,发生还原反应 ③每生成19.2 g Ti,反应(1)、(2)中共转移4.8 mol e- ④a=1,b=c=2
A.①②④ B.②③④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第13练物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC3—的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
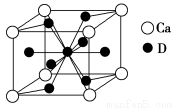
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com