
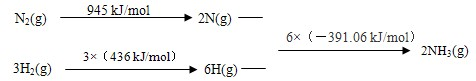
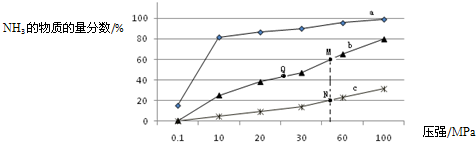
| n(反应的) |
| n(加入的) |
| ||
| ||
 2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)  2NH3(g)△H=-93.36 kJ/mol;
2NH3(g)△H=-93.36 kJ/mol; 2NH3(g)
2NH3(g)| 2x |
| 1-x+3-3x+2x |
| 3 |
| 4 |
3×
| ||
| 3 |
 NH3?H2O+H+SO32-+H2O
NH3?H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性,
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性, NH3?H2O+H+SO32-+H2O
NH3?H2O+H+SO32-+H2O HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;
HSO3-+OH-,SO32-水解程度大于NH4+ 的水解程度使溶液中c(OH-)>c(H+),溶液呈碱性;

 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
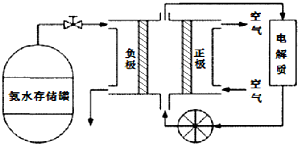
 利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )
利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )| A、若X为锌棒,开关K置于M处,铁极发生还原反应 |
| B、若X为碳棒,开关K置于N处,X极发生还原反应 |
| C、若X为碳棒,开关K置于N处,可加快铁的腐蚀 |
| D、若X为锌棒,开关K置于M处,可加快铁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度的:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列顺序是①④②⑥③⑤ |
| B、标况下,将0.1mol?L-1的氨水溶液中加入氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C、饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液中HPO43-、PO43-、H+的浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞变红色的溶液:Na+、Ba2+、Cl-、NO3- |
| B、空气:C2H6、CO2、SO2、NO |
| C、氯化铁溶液:H+、K+、NO3-、I- |
| D、高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛,也能被氧化为乙酸 |
| C、苯与溴水在Fe3+催化下发生取代反应生成溴苯 |
| D、硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃容器可长期盛放各种酸 |
| B、纯碱可用于清洗油污 |
| C、浓氨水可检验氯气管道漏气 |
| D、Na2S可除去污水中的Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com