
下列说法不正确的是( )
|
| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 |
|
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 |
|
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 |
|
| D. | 2﹣氯﹣2﹣甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
考点:
化学方程式的有关计算;淀粉的性质和用途;物质的分离、提纯和除杂.
分析:
A、乙醛和乙酸乙酯的最简式均为CH2O;
B、淀粉水解的最终产物为葡萄糖,含﹣CHO;
C、饱和碳酸钠可与乙酸反应,并降低乙酸乙酯的溶解度;
D、2﹣氯﹣2﹣甲基丙烷在氢氧化钠的醇溶液中加热会发生消去反应,据此回答.
解答:
解:A、乙醛和乙酸乙酯的最简式均为CH2O,等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量相等,故A正确;
B、淀粉水解的最终产物为葡萄糖,含﹣CHO,具有还原性,加热条件下与新制氢氧化铜反应生成砖红色沉淀,故B正确;
C、饱和碳酸钠可与乙酸反应,并降低乙酸乙酯的溶解度,则可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,故C正确;
D、2﹣氯﹣2﹣甲基丙烷在氢氧化钠的醇溶液中加热会发生消去反应,可生成2﹣甲基﹣1﹣丙烯,故D错误.
故选D.
点评:
本题考查较综合,涉及有机物的性质、混合物的分离提纯、有机反应等,侧重淀粉、乙酸的性质及乙醛和乙酸乙酯组成的考查,题目难度不大


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2﹣、Al3+、CO32﹣、NO3﹣七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是( )
A. 溶液中可能含有AlO2﹣
B. 溶液中可能含有NO3﹣
C. 溶液中一定不含Fe2+和Fe3+
D. 溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
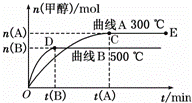
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g).根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=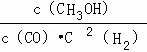 ,,升高温度,K值减小(填“增大”、“减小”或“不变”),平衡向逆反应方向移动.
,,升高温度,K值减小(填“增大”、“减小”或“不变”),平衡向逆反应方向移动.
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的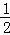 ,下列有关该体系的说法正确的是 (选填选项字母).
,下列有关该体系的说法正确的是 (选填选项字母).
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时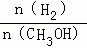 增大
增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是 (用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列营养物质在人体内发生的变化及其对生命活动所起的作用叙述不正确的是( )
|
| A. | 淀粉→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
|
| B. | 纤维素(水解)→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
|
| C. | 油脂→(水解)甘油和高级脂肪酸→(氧化)水和二氧化碳(释放能量维持生命活动) |
|
| D. | 蛋白质→(水解)氨基酸氨基酸→(合成)人体所需的蛋白质(人体生长发育) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①N2(g)+3H2(g) 2NH3(g)△H<0,
2NH3(g)△H<0,
②2SO2(g)+O2(g) 2SO3(g)△H<0.请回答下列问题:
2SO3(g)△H<0.请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是适当温度、高压、催化剂.实际生产中采取的措施,合成氨是 ,合成SO3是 .
(2)在合成氨的工业生产中,要分离出氨,目的是 ;而合成SO3的过程中,则不需要分离出SO3,原因是 .
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应②在一定条件下达到平衡,测得c(SO3)=0.040mol•L﹣1.计算该条件下反应②的平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列化学反应的离子方程式
的是 ( )
A.向碳酸氢铵溶液中加入过量的NaOH固体 NH4++OH-= NH3↑+H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com