
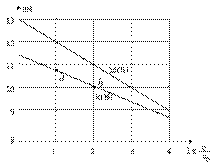
 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随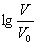 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当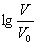 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 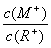 增大
增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1个,Y的最外层电子数比K层多1个,Z的单质常用于制造太阳能电池,W的原子半径 是同周期主族元素中最小的。下列推断中正确的是( )
是同周期主族元素中最小的。下列推断中正确的是( )
A.Z的简单氢化物的热稳定性强于W的简单氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的简单离子半径依次增大
D.X、Y、W的最高价氧化物对应的水化物之间互相都能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”(含有少量的Cl-、Fe3+)。某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是______(填化学式,下同)。
(2)在操作①中保持pH=8的目的是__________________________________________。
(3)沉淀Ⅰ的主要成分是____________。
(4)操作③中加热煮沸的目的是________________;此步操作的理论依据是
________________________________________________________________________。
(5)操作④保持pH=2的目的是____________;此步操作中所用的主要仪器是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?) 2C(g)+D(g),
2C(g)+D(g),
C的体积分数(C%) 随时间的变化趋势符合下图关系:
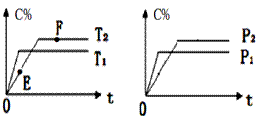
下列说法正确的是
A.E点的v(逆)大于F点的v(正)
B.若给容器加热,该反应的平衡常数K将增大
C.若在F点时给容器加压,达新平衡时C的浓度将增大
D.在恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.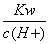 <1.0×10-7mol/L
<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
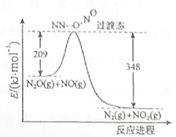
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g) 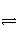
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g) 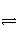
 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+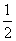 O2(g)
O2(g) 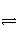
 SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+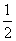 O2(g)
O2(g) 
 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com