
| A. | △H1>0 | B. | △H2>0 | C. | △H2<△H3 | D. | △H5=2△H4+△H1 |
分析 有C参加的氧化还原反应为吸热反应;由C(s)+H2O(g)=CO(g)+H2(g)△H2、CO(g)+H2O(g)=CO2(g)+H2(g)△H3可知两式相减得到CO2(g)+C(s)=2CO(g)△H1,由CO2(g)+C(s)=2CO(g)△H1、CuO(s)+CO(g)=Cu(s)+CO2(g)△H4可知第一个反应与第二个反应乘以4的加和得到2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5,以此计算解答.
解答 解:A.CO2(g)+C(s)=2CO(g)为有碳参加的氧化还原反应,为吸热反应,则△H1>0,故A正确;
B.C(s)+H2O(g)=CO(g)+H2(g)为有碳参加的氧化还原反应,为吸热反应,则△H2>0,故B正确;
C.由C(s)+H2O(g)=CO(g)+H2(g)△H2、CO(g)+H2O(g)=CO2(g)+H2(g)△H3,结合盖斯定律可知两是相减得到CO2(g)+C(s)=2CO(g),则△H1=△H2-△H3>0,即△H2>△H3,故C错误;
D.由①CO2(g)+C(s)=2CO(g)△H1、④CuO(s)+CO(g)=Cu(s)+CO2(g)△H4,结合盖斯定律可知①+④×②得到2CuO(s)+C(s)=2Cu(s)+CO2(g),则△H5=2△H4+△H1,故D正确;
故选C.
点评 本题考查反应热的计算,为高频考点,把握氧化还原反应中能量变化及盖斯定律计算反应热为解答的关键,侧重分析与应用能力、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

 ;反应③
;反应③ .
.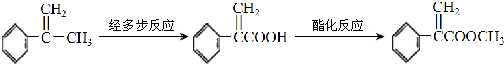
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应Ⅰ | 反应Ⅱ |
| A | 甲烷与氯气在光照下生产一氯甲烷 | 乙烯与溴的四氯化碳溶液反应 |
| B | 乙醇催化氧化生成乙醛 | 由淀粉得到葡萄糖 |
| C | 由油脂得到甘油 | 乙烯制备聚乙烯 |
| D | 苯与浓硫酸浓硝酸反应生成硝基苯 | 乙醇和乙酸反应制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
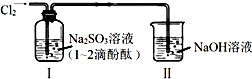
| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 通入Cl2后,装置Ⅰ中溶液不褪色 | |
| D. | 装置Ⅱ的作用是吸收尾气,防止污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.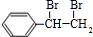 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$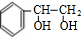 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.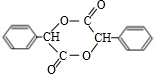 .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com