
| 1.2mol |
| 2L×2s |
| 1.4mol |
| 2L |


科目:高中化学 来源: 题型:
| A、3.2g | B、4.43g |
| C、10.8g | D、12.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、过量的SO2通入氨水中:NH3?H20+SO2
| ||||
B、实验室制备氯气:MnO2+4H++2Cl-
| ||||
C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-
| ||||
D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:
(1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
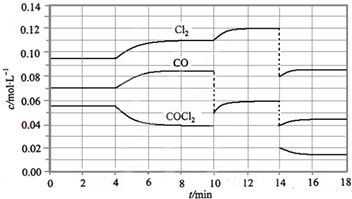
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com