
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |
分析 X、Y都是短周期元素,X原子最外层只有一个电子,所以X是第ⅠA族元素,可能是H或Li或Na元素;Y元素的最高正价与最低负价的代数和为6,该元素属于第ⅦA元素,F元素没有正价,所以Y是氯元素;X和Y两元素形成的化合物为HCl或LiCl或NaCl,据此解答.
解答 解:X、Y都是短周期元素,X原子最外层只有一个电子,所以X是第ⅠA族元素,可能是H或Li或Na元素;Y元素的最高正价与最低负价的代数和为6,该元素属于第ⅦA元素,F元素没有正价,所以Y是氯元素;X和Y两元素形成的化合物为HCl或LiCl或NaCl.
A.R可能是气态物质,如氯化氢;也可能是固态物质,如LiCl和NaCl,故A错误;
B.R不一定是离子化合物,如氯化氢,故B错误;
C.R不一定是共价化合物,如LiCl和NaCl,故C错误;
D.R可能是共价化合物,如氯化氢;也可能是离子化合物,如LiCl和NaCl,故D正确;
故选:D.
点评 本题考查结构性质位置关系应用,难度不大,明确可能的元素是解题关键,注意:离子化合物中可能含有共价键,如NaOH,共价化合物中一定没有离子键,并不是所有的物质都含有化学键,如稀有气体是单原子分子,不存在化学键.


科目:高中化学 来源: 题型:解答题
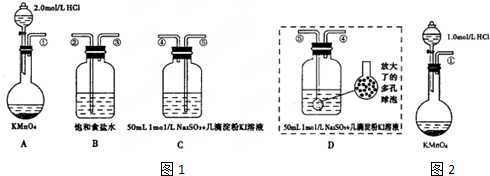
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+HCO3-NO3-ClO- | B. | Na+SO32-NH4+Ba2+ | ||
| C. | Ba2+ HS-Cl-SO42- | D. | AlO2-CO32-Cl-Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、Mg2+、K+、Al3+ |
| 阴离子 | HCO3-、MnO4-、SO42-、Cl- |
| A. | 肯定没有 Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有 K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质的熔点不会很高、硬度不会很大 | |
| B. | 该物质形成的晶体属于分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | 该物质的相对分子质量为2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 官能团名称 | 羧基 | 羟基 | 碳碳双键 | 不填 |
| 官能团数目 | 1 | 1 | 1 | 不填 |
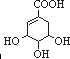 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 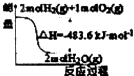 表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ•mol-1 | |
| B. | 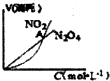 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 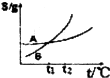 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 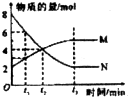 图中在t2时刻正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com