
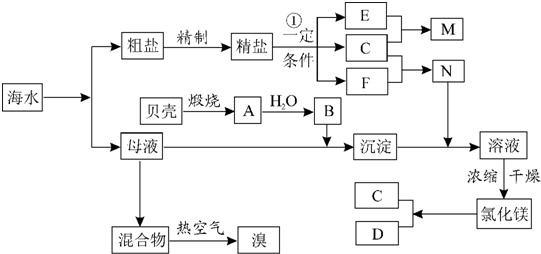
 ;
;分析 根据流程图知:反应②为精盐溶液的电解,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,C+F→N,N能溶解沉淀,C既能和F反应又能和E反应,所以,E为NaOH,F为H2,C为Cl2,N为HCl,贝壳(主要成分为CaCO3)经过高温煅烧可以生成疏松的氧化钙(A),氧化钙可与水反应生成氢氧化钙(B),与母液反应生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解可生成氯气和镁,由转化关系可知D为Mg,以此解答该题.
(1)根据碳酸钙以及氧化钙的性质来回答;
(2)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠;得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂;
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(4)先提取Mg,后提取Br2,海水中会残留大量Ca(OH)2,Ca(OH)2能和氯气反应生成氯化钙和次氯酸钙和水
(5)①根据题意可设镁的质量为24克,然后利用化学反应方程式分别计算反应后的固体产物的质量,比较大小可以得出答案;
②令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2.
解答 解:根据流程图知:反应②为精盐溶液的电解,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,C+F→N,N能溶解沉淀,C既能和F反应又能和E反应,所以,E为NaOH,F为H2,C为Cl2,N为HCl,贝壳(主要成分为CaCO3)经过高温煅烧可以生成疏松的氧化钙(A),氧化钙可与水反应生成氢氧化钙(B),与母液反应生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解可生成氯气和镁,由转化关系可知D为Mg,
(1)根据流程图知:反应2为精盐溶液的电解,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,C+F→N,N能溶解沉淀,C既能和F反应又能和E反应,所以,E为NaOH,F为H2,C为Cl2,N为HCl,贝壳(主要成分为CaCO3)经过高温煅烧可以生成疏松的氧化钙,氧化钙可与水反应生成氢氧化钙,所以B为石灰乳,
故答案为:石灰乳;
(2)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,得电子化合价降低的物质是水,所以水是氧化剂,失电子化合价升高的物质是氯化钠,所以氯化钠是还原剂,电子转移总是为2e-,双线桥标注为: ,
,
故答案为: ;
;
(3)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,故选AD;
故答案为:AD.
(4)母液用来提取Mg和Br2,若先提取镁,海水中会残留大量Ca(OH)2,Ca(OH)2能和氯气反应生成氯化钙和次氯酸钙和水,再用Cl2提取溴时会消耗大量Cl2,所以乙观点合理,甲方案不合适,提取Mg时用的Ca(OH)2有剩余,所以通入氯气会和它 反应,造成浪费;乙方案合适,电解MgCl2产生的Cl2可用于下一次Br-的氧化,
故答案为:甲方案不合适,提取Mg时用的Ca(OH)2有剩余,所以通入氯气会和它 反应,造成浪费;乙方案合适,电解MgCl2产生的Cl2可用于下一次Br-的氧化;
(5)①a.设24克镁在氧气中完全燃烧生成物的质量为X,
2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO
48 80
24 X
解得X=40克
b.设24克镁在氮气中完全燃烧生成物的质量为Y,
3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2
72 100
24g Y
Y=33.3克
c.设24克镁在二氧化碳中完全燃烧生成物的质量分别为Z1和Z2,则
2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
48 80 12
24 Z1 Z2
解得Z1=40克,Z2=6克,即镁在二氧化碳中完全燃烧生成物的质量为46克,
显然c>a>b,
故答案为:c>a>b;
(4)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2;
点评 本题考查方程式的书写及其利用化学反应方程式进行计算,涉及无机物的推断以及物质的分离、提纯的实验设计,为高频考点,侧重于学生的分析能量和实验能力的考查,主要把握实验的原理和操作方法,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
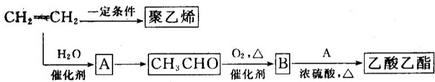
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
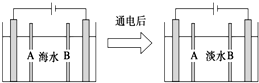
| A. | 阳离子交换膜是A,不是B | |
| B. | 通电后阳极区的电极反应式:2Cl--2e-═Cl2↑ | |
| C. | 工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 | |
| D. | 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
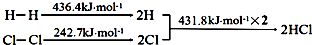
| A. | H-H键比Cl-Cl键稳定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反应活化能比逆反应活化能高 | |
| D. | 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com