
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
| D | 某溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀 | 该溶液中含有Cl- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.燃烧为剧烈的氧化还原反应;
B.氧化铝的熔点高,包裹在Al的外面;
C.迅速熔成银白色小球,说明熔点低;
D.白色沉淀为AgCl.
解答 解:A.燃烧为剧烈的氧化还原反应,该实验无氧气参加,现象可说明结论,故A正确;
B.氧化铝的熔点高,包裹在Al的外面,则铝箔在酒精灯火焰上加热熔化但不滴落,故B正确;
C.迅速熔成银白色小球,说明熔点低,不能说明密度大小,故C错误;
D.白色沉淀为AgCl,则该溶液中含有Cl-,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、离子检验、性质实验为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:实验题

| 实验操作及现象 | ④向2mL 0.2mol/L FeCl3溶液中滴入2mL1mol/L NaF溶液,溶液变无色. |
| ⑤向2mL 0.2mol/L FeCl3溶液中滴入2mL 蒸馏水,溶液颜色变浅. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
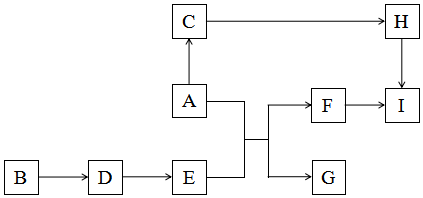
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
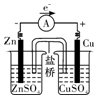
| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电流方向从锌片经导线流向铜片 | D. | 铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com