
分析 (1)同一周期元素,元素电负性能随着原子序数增大而增大;Fe原子3d、4s能级电子为其价电子;
(2)熔沸点较低的晶体为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式;该配体中Cu原子提供空轨道、N原子提供孤电子对;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{m}{V}$计算.
解答 解:(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是0>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布式为3d64s2,故答案为:0>N>C;3d64s2;
(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳,
反应方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2,故答案为:分子晶体;4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对,故答案为:sp3、sp2;N;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,故答案为:bd;
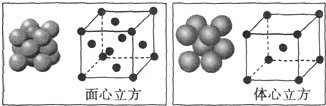
(5)利用均摊法计算晶胞中Fe原子个数,面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,所以二者Fe原子个数之比=4:2=2:1;设Fe原子半径为rcm,面心立方晶胞半径=$2\sqrt{2}$rcm,其体积=$(2\sqrt{2}rcm)^{3}$,体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,其体积=$(\frac{4\sqrt{3}}{3}rcm)^{3}$,其密度之比=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}rcm)^{3}}$:$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4\sqrt{3}}{3}rcm)^{3}}$=$4\sqrt{2}$:$3\sqrt{3}$,故答案为:2:1;$4\sqrt{2}$:$3\sqrt{3}$.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,难点是晶胞计算,注意Fe晶胞面心立方和体心立方区别,关键会正确计算两种晶胞体积,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| B. | 通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
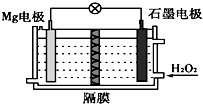
| A. | Mg 电极是该电池的正极 | B. | H2O2 在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH 增大 | D. | 溶液中Cl-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com