
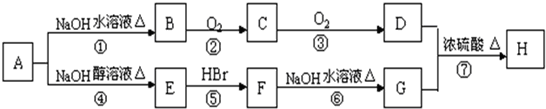
| ① | ② | ③ | ④ |
 |  |  |  |
| 防治高血压 | 防治缺铁性贫血 | 做甜味剂 | 做防腐剂 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
科目:高中化学 来源: 题型:填空题
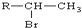 (R为烃基)
(R为烃基) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
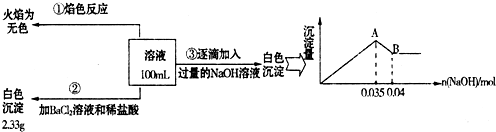
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极开发和利用新能源,减少煤、石油等化石燃料的使用量 | |
| B. | 明矾净水的原理和家用消毒液消毒的原理相同 | |
| C. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 | |
| D. | 雾霾的形成与工厂废气的排放有关,与汽车尾气无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下能迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能干燥二氧化硫、氢气、氨气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝表面形成氧化膜而钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
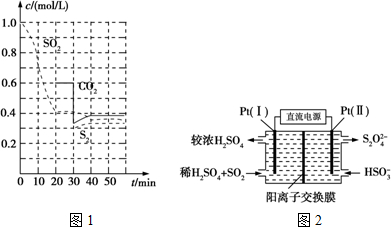
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
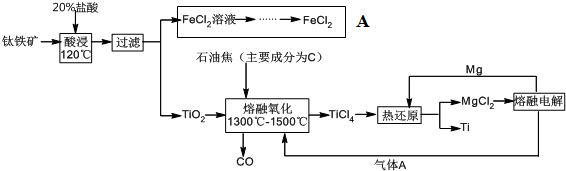
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com