
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
分析 每次均有金属剩余,说明反应后溶液中肯定没有Fe3+,肯定有Fe2+,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,3Fe+8H++2NO3-=Fe2++2NO↑+4H2O,
而有金属剩余,知道反应后溶液中必然不含H+,而NO3-只有$\frac{1}{4}$被还原:0.12mol×$\frac{1}{4}$=0.03mol,设溶解Cu为xmol,溶解Fe为ymol,根据方程式及剩余金属质量列方程解答;
第二次又加入H+为:0.05L×0.4mol/L×2=0.04mol,从方程式看出又有0.01mol的NO3-进一步被还原.如果金属全部消耗的是Fe,计算金属质量减少,如果金属消耗的都是Cu,计算金属质量减少,与实际金属质量减少比较判断第一次剩余的金属,据此进行解答.
解答 解:每次均有金属剩余,说明反应后溶液中肯定没有Fe3+,肯定有Fe2+,发生反应:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3 8 2
第一次加入H+和NO3-均为:0.2L×0.6mol/L=0.12mol,而有金属剩余,则反应后溶液中必然不含H+,而NO3-只有$\frac{1}{4}$被还原:0.12mol×$\frac{1}{4}$=0.03mol;
设溶解Cu为xmol,溶解Fe为ymol,则:xmol+ymol=$\frac{3}{8}$×0.12mol;且 64g/mol×xmol+56g/mol×ymol=8.08g-5.44g=2.64g.解这个方程组,得:x=0.015,y=0.03;
第二次又加入H+为:0.05L×0.4mol/L×2=0.04mol,从方程式看出又有0.01mol的NO3-进一步被还原.而如果金属全部消耗的是Fe,则金属必然减少:56g/mol×$\frac{3}{8}$×0.04mol=0.84g<5.44g-4.48g=0.96g;
而如果金属消耗的都是Cu,则金属减少:64g/mol×$\frac{3}{8}$×0.02mol=0.96g=5.44g-4.48g=0.96g,说明消耗的只有Cu.则可知第一次反应后剩余的5.44g金属全部是Cu,
A.根据分析可知,第一次反应后剩余的5.44g金属全部是Cu,故A错误;
B.根据分析可知,第一次反应后剩余的5.44g金属全部是Cu,故B正确;
C.根据分析可知,n(NO)=n(NO3-)=0.03mol+0.01mol=0.04mol,故C错误;
D.根据分析可知,原混合物中含Cu:0.015mol×64g/mol+5.44g=6.4g,含Fe为:0.03mol×56g/mol=1.68g,原混合物中金属铁的质量分数为:$\frac{1.68g}{8.08g}$×100%=20.8%,故D正确;
故选BD.
点评 本题考查混合物的有关计算,题目难度中等,判断第一次剩余的金属组成是解题的关键,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 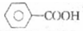 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 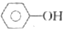 和 和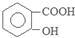 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
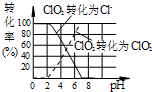 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝能溶于强碱溶液 | B. | 铝片能与盐酸反应生成氢气 | ||
| C. | 氯化铝溶液显酸性 | D. | 铝能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实 验 步 骤 | 现 象 | 探究目的和结论 |
| ③ | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | 探究目的:探究空气中的O2对苹果“褐变”的影响 结论:“褐变”是苹果中的某些物质与空气中的O2发生反应,生成有色物质.(或没有空气O2的参与,苹果不发生“褐变” |
| ④ | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中. 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中.将盐酸改为酒精、醋酸铅溶液进行相同实验. | 相当长一段时间内,均无明显变化 | 探究目的:探究氧化酶对苹果“褐变”的影响 结论:经加热或稀盐酸浸泡,酶变性而失去催化能力,没有氧化酶的催化,苹果不发生“褐变”.(或苹果发生“褐变”,必须在氧化酶的催化下才能发生. . |
| ⑤ | 在刚削皮的苹果上滴加FeCl3溶液. | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质. 结论:苹果中含有酚类物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
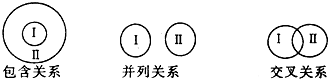
| A. | 电解质与非电解质属于包含关系 | |
| B. | 化合物与碱性氧化物属于包含关系 | |
| C. | 单质与化合物属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com