
| A. | 在由水电离产生的C(OH-)=1×10-12 mol•L-1的溶液中,K+、Al3+、SO42-、Cl-一定可以大量共存 | |
| B. | 由0.1 mol/L一元碱BOH溶液的pH=10,可推知BCl溶液呈酸性 | |
| C. | 在pH=0的溶液中,K+、Fe2+、Cl-、NO3-可以大量共存 | |
| D. | 含碳酸氢钠的溶液:K+、SO42-、Cl-、H+能大量共存 |
分析 A.在由水电离产生的C(OH-)=1×10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应;
B.0.1 mol/L一元碱BOH溶液的pH=10,溶液中氢氧根离子浓度为1×10-4mol/L,说明BOH部分电离,为弱碱;
C.pH=0的溶液呈酸性,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.氢离子与碳酸氢钠反应.
解答 解:A.在由水电离产生的C(OH-)=1×10-12 mol•L-1的溶液为酸性或碱性,Al3+与碱性溶液中的氢氧根离子反应,在碱性溶液中不能大量共存,故A错误;
B.pH=10的溶液中氢氧根离子浓度为1×10-4mol/L,说明BOH在溶液中只能部分电离出氢氧根离子,则BOH为弱碱,BCl为强酸弱碱盐,所以BCl溶液呈酸性,故B正确;
C.在pH=0的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.碳酸氢钠与H+发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2 | B. | CH3-CH2-CH═CH2 | C. |  | D. | CH2═CH-CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
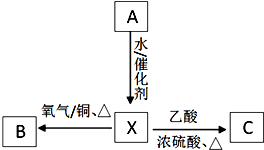 A为最简单的植物激素.有关物质的转化关系如图:
A为最简单的植物激素.有关物质的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-作还原剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
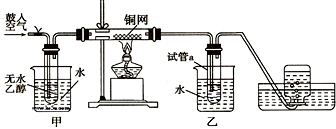
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
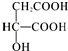 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. | 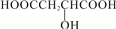 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [加成反应]
[加成反应]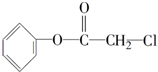 与NaOH溶液共热:
与NaOH溶液共热: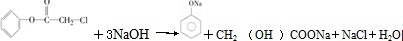 [取代反应].
[取代反应].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第14列元素的最高价氧化物的化学式为RO2 | |
| B. | 第2列元素中一定没有非金属元素 | |
| C. | 在18列元素中,第3列元素种类最多 | |
| D. | 第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com