
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 | ||
二苯基羟乙酮 | 212 | 133 | 344 | 1.310 | 不溶于冷水,溶于乙醇 | |
二苯基乙二酮 | 210 | 97 | 348 | 1.084 | 不溶于水,能溶于乙醇 |
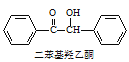 +2FeCl3
+2FeCl3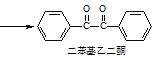 +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
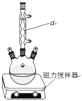
(1)装置图中仪器a的名称是____,其作用是____。
(2)加入碎瓷片的作用是____。若加热后发现未加碎瓷片,应采取的正确方法是___。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。如图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:

该实验条件下加热____后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是____。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是_____。
(7)本实验的产率是____%。(保留3位有效数字)
【答案】球形冷凝管 冷凝回流 防止暴沸 停止加热,待冷却后补加 C 趁热过滤 所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸 二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小 85.7
【解析】
(1)仪器a的名称是球形冷凝管,其作用是冷凝回流,可减少二苯基乙二酮、二苯基羟乙酮的损失;
(2)烧瓶中加热液体时均需加入碎瓷片防止液体暴沸;若加热后发现未加碎瓷片,应采取的正确方法是停止加热,待冷却后补加;
(3)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流15min、30min时的图上,下面的斑点为反应物,上面的斑点为生成物,45min时则图上的斑点是生成物,而反应物基本上无剩余,据此解答;
(4)根据重结晶的过程判断每一步的作用,趁热过滤可以除去不溶性杂质;
(5)乙醇作为重结晶的溶剂,但是乙醇易挥发出乙醇蒸气,与空气混合遇明火爆炸,据此解答;
(6)根据二者的熔沸点选择分离方式;
(7)列比例计算二苯基乙二酮的理论产量,进而计算产率。
(1)仪器a的名称是球形冷凝管,其作用是冷凝回流,减少二苯基乙二酮、二苯基羟乙酮的损失;
故答案为:球形冷凝管;冷凝回流;
(2)加入碎瓷片的作用是防止暴沸;若加热后发现未加碎瓷片,应采取的正确方法是停止加热,待冷却后补加;
故答案为:防止暴沸;停止加热,待冷却后补加;
(3)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流15min、30min时的图上,下面的斑点为反应物,上面的斑点为生成物,45min时则图上的斑点是生成物,而反应物基本上无剩余。因此,该实验条件下加热45min后可认为反应结束;
故答案为:C;
(4)重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中活性炭脱色可以除去有色杂质,趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质,则上述重结晶过程中,趁热过滤操作除去了不溶性杂质;
故答案为:趁热过滤;
(5)在重结晶过程中,用的是70%乙醇水溶液重结晶提纯二苯基乙二酮,乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸,因此在重结晶过程中,不可选用明火直接加热;
故答案为:所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸;
(6)二苯基乙二酮粗产品为固体混合物,且二苯基乙二酮与二苯基羟乙酮的沸点差别较小,
因此不选择蒸馏的方法提纯二苯基乙二酮粗产品;
故答案为:二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小;
(7)理论上2.12 g二苯基羟乙酮完全反应,其物质的量为![]() ,则理论上生成二苯基乙二酮为0.1mol,其质量为m=nM=0.01mol×210g/mol=2.1g,则其产率为
,则理论上生成二苯基乙二酮为0.1mol,其质量为m=nM=0.01mol×210g/mol=2.1g,则其产率为![]() ;
;
故答案为:85.7。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法正确的是( )。
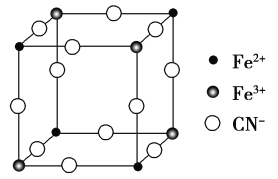
A. 该晶体属于离子晶体,M呈+1价
B. 该晶体属于离子晶体,M呈+2价
C. 该晶体属于分子晶体,化学式为MFe2(CN)6
D. 晶体中与每个Fe3+距离最近且等距离的CN-有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。

(1)小麦种子中的储能物质c是________,人和动物细胞中的储能物质c是________。
(2)组成b的多肽是由氨基酸通过脱水缩合连接而成,脱水缩合是指____________________。
(3)用洋葱鳞片叶______(填“内”或“外”)表细胞,可以通过染色来观察DNA和e的分布,实验操作步骤中要用盐酸水解,目的有改变细胞膜的通透性,加速染色剂进入细胞,同时使______________________,利于DNA与染色剂结合。
(4)人体摄入的d中_______参与血液中脂质的运输,维生素D能有效地促进__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
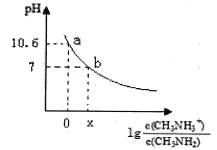
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
① 2-甲基丁烷和丁烷________________, ②正戊烷和2,2-二甲基丙烷____________,③对二甲苯和1,4—二甲苯____________ , ④ 1-已烯和环已烷________________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
① CH3CH2CH2COOH ② ![]() ③
③![]()
④ ![]() ⑤
⑤ ![]() ⑥
⑥ 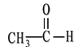
(1)芳香烃:__________;
(2)卤代烃:____________;
(3)酚:_______________;
(4)醛:______________;
(5)羧酸:______________;
(6)酯:_______________。
III.(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)![]() N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1D. 容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
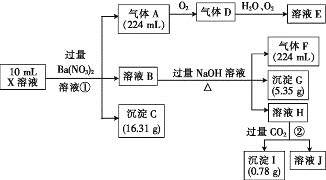
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com