
| A. | 蒸馏液体时,冷水应从冷凝管的上端进入,下端流出,符合水往低处流原理 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧靠烧杯内壁 | |
| C. | 进行蒸发操作时,待固体全部析出时再停止加热 | |
| D. | 分液时,当静置分层后,打开旋塞,使下层液体流出,待下层液刚好流尽后,立即关闭旋塞,再换另一只烧杯,再打开旋塞,将上层液体流出 |
分析 A.冷凝水方向与气流方向相反;
B.三层滤纸较厚;
C.当出现多量固体时,就停止加热,利用蒸发皿的余热使滤液蒸干;
D.分液时应防止液体重新混合而污染.
解答 解:A.冷凝水应下进上出,故A错误;
B.三层滤纸较厚,过滤操作时不易被玻璃棒捅破,故B正确;
C.蒸发时,当出现多量固体时,就停止加热,利用蒸发皿的余热使滤液蒸干,故C错误;
D.分液时,下层液体流出,上层液体从上口倒出,以防止液体重新混合而污染,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的分离和制备,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol14CH4分子中所含中子数为8NA | |
| B. | 7g14C原子形成的石墨中所含质子数为3NA | |
| C. | 17g甲基(-14CH3)所含电子数为8NA | |
| D. | 标准状况下22.4L14CO2的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 | |
| B. | X、Y、Z组成的一种离子化合物,其中X、Y、Z元素原子个数比可能为4:2:3 | |
| C. | X和Z可以形成X2Z和X2Z2型化合物,所含共价键类型不完全相同 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
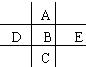 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: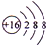 .A单质的电子式为
.A单质的电子式为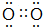 .
.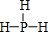 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
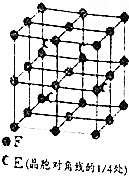 A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.
A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.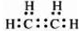 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com