
| A、常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-) |
| D、pH=2和pH=1的硝酸中c(H+)之比为1:10 |


科目:高中化学 来源: 题型:
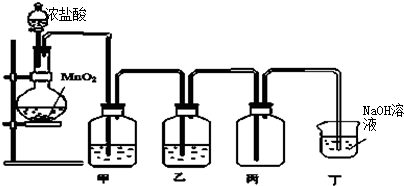
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 六种一溴二甲苯的熔点 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205 |
| 对应还原二甲苯的熔点 | -13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素的单质可以把B元素的单质从NaB溶液中置换出来 |
| B、NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高 |
| C、HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol HB分子中H-B键断裂时吸收的能量多 |
| D、常温下,NaA、NaB溶液的pH均大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7mol?L-1 |
| B、5mol?L-1 |
| C、4mol?L-1 |
| D、3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 2SO2(g)+O2(g)?2SO3(g)△H=-akJ?mol-1 |
B、 N2(g)+3H2(g)?NH3(g)△H=-bkJ?mol-1 |
C、 N2O4(g)?2NO2(g)△H=+ckJ?mol-1 |
D、 CO2(g)+C(s)?2CO(g)△H=+dkJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③④ |
| C、①②③ | D、④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com