
 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.
分析 (1)基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;烃分子中,氢元素和碳元素的原子个数之比数值越大,H元素质量分数含量越高;
(2)烷烃中出现乙基,则主链至少含有5个C,据此写出该有机物的结构简式;
(3)根据炔的加成原理,三键中的两个键断开,结合H原子,生成2-甲基丁烷,采取倒推法相邻碳原子之间各去掉2个氢原子形成三键,即得到炔烃;
(4)①依据CH2=CH-CH2-Cl可知其官能团为碳碳双键和氯原子;
②CH2=CH-CH2-Cl含有碳碳双键能够与溴水发生加成反应,碳碳双键中1个键断开,分别在两个碳原子上各加1个溴原子.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ;甲烷中氢元素和碳元素的原子个数之比数值越大,H元素质量分数含量最高,分子式为:CH4;
;甲烷中氢元素和碳元素的原子个数之比数值越大,H元素质量分数含量最高,分子式为:CH4;
故答案为: ;CH4;
;CH4;
(2)烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为 ,
,
故答案为: ;
;
(3)2-甲基丁烷的碳链结构为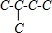 ,2-甲基丁烷相邻碳原子之间各去掉2个氢原子形成三键,从而得到炔烃;根据2-甲基丁烷的碳链结构,可知相邻碳原子之间各去掉2个氢原子形成三键只有一种情况,所以该炔烃的碳链结构为
,2-甲基丁烷相邻碳原子之间各去掉2个氢原子形成三键,从而得到炔烃;根据2-甲基丁烷的碳链结构,可知相邻碳原子之间各去掉2个氢原子形成三键只有一种情况,所以该炔烃的碳链结构为 ,该炔烃的名称为3-甲基-1-丁炔,
,该炔烃的名称为3-甲基-1-丁炔,
故答案为:3-甲基-1-丁炔;
(4)①依据CH2=CH-CH2-Cl可知其官能团为碳碳双键和氯原子;
故答案为:碳碳双键 氯原子;
②CH2=CH-CH2-Cl含有碳碳双键能够与溴水发生加成反应,方程式:CH2=CH-CH2-Cl+Br2→CH2 Br CH Br CH2Cl;
故答案为:CH2=CH-CH2-Cl+Br2→CH2 Br CH Br CH2Cl.
点评 本题考查了电子式、结构简式、化学方程式的书写,明确有机物结构特点是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: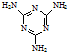 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com