
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3所具有的能量 | |
| B. | 将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
分析 A、该反应正反应是放热反应,反应物的总能量大于生成物的总能量,反应能量变化需要一定量物质条件下比较;
B、反应是可逆反应,不能进行完全;
C、反应是气体体积减小的放热反应,结合温度、压强对平衡影响判断;
D、依据焓变结合热化学方程式计算判断.
解答 解:A、反应是放热反应,相同条件下,2molSO2(g)和1molO2(g)所具有的能量大于2molSO3(g)所具有的能量,故A错误;
B、将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于QkJ,故B错误;
C、反应是气体体积减小的放热反应,增大压强平衡正向进行,升高温度,该平衡向逆反应方向移动,故C错误;
D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,参加反应的二氧化硫为2mol,故一定有2molSO2(g)被氧化,故D正确;
故选D.
点评 本题考查了热化学方程式的应用、化学平衡的影响因素等,关键是可逆反应的焓变的意义理解,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中通入过量的CO2:CO2+2OH-═CO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的浓HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是硫及其化合物的分类图,请回答下列问题:
下面是硫及其化合物的分类图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Mg2+、AlO2-、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
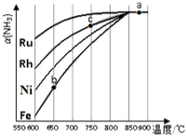 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

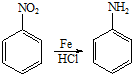
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$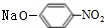 +NaCl+H2O.
+NaCl+H2O.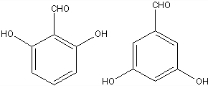 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1是指1秒钟时某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 化学反应的速率可以是g•(L•s)-1,也可以是kg•(L•s)-1,甚至可以用t•(L•s)-1表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
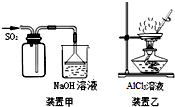
| A. | 用装置甲收集SO2 | |
| B. | 用装置乙制备AlCl3晶体 | |
| C. | 中和滴定时,锥形瓶用待装液润洗 | |
| D. | 使用分液漏斗和容量瓶时,先要检查是否漏液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com