
| A、Na+、NO3-、Mg2+、Cl- |
| B、Na+、CO32-、NO3-、Ca2+ |
| C、K+、Cl-、SO42-、Cu2+ |
| D、Ba2+、Cl-、K+、SO42- |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
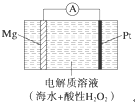 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、水分子可表示为H-O-H,分子中键角为180. |
| C、H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时消耗能量为2×463KJ |
| D、元素周期表中的第ⅠA族和第ⅦA族元素的原子间可以形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 75℃ | - | - | 1mL | 100s |
| 2 | 75℃ | 10滴 | - | 1mL | 40s |
| 3 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量,将产生的气体通入 . | |
| 步骤2:向步骤1得到的溶液中滴加几滴. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定不含Fe3+和Fe2+ |
| B、溶液可能含有AlO2- |
| C、溶液可能含有NO3- |
| D、可能含有Fe3+但一定不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com