

分析 (1)根据装置图可知仪器名称;
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置用来吸收二氧化碳和水蒸气;
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式,根据方程式中转移电子数目计算出NO的体积;
(4)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算;
(5)NO2与水反应生成一氧化氮和硝酸,一氧化氮和氧气反应生成二氧化氮,据此确定试管中NO2完全被水吸收的操作.
解答 解:(1)根据装置图可知a仪器的名称为分液漏斗,故答案为:分液漏斗;
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置装碱石灰(或氢氧化钠固体或氧化钙固体),用来吸收二氧化碳和水蒸气,
故答案为:碱石灰(或氢氧化钠固体或氧化钙固体);
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式为2NO+Na2O2=2NaNO2,该反应中电子转移数目为1e-,根据方程式可知,当反应中转移0.1mole-时,吸收NO的物质的量为0.1mol,则NO的体积为2.24L,
故答案为:2NO+Na2O2=2NaNO2;2.24;
(4)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO,有关系式C~4NO2~$\frac{4}{3}$NO~$\frac{8}{3}$HNO3,根据③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
有关系式HNO3~$\frac{3}{8}$Cu~$\frac{1}{2}$NO,则有C~$\frac{2}{3}$NO,所以碳与总的NO的关系式为C~($\frac{4}{3}$+$\frac{2}{3}$)NO,根据④2NO+Na2O2═2NaNO2,可知碳与Na2O2的关系式为C~Na2O2,所以11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要碳的质量为$\frac{11.7}{78}$×12g=1.8g,
故答案为:1.8.
(5)①NO2与水反应生成一氧化氮和硝酸,反应方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
②由于一氧化氮和氧气反应生成二氧化氮,结合①中的反应可得反应4NO2+H2O+O2═4HNO3,所以要使此试管中NO2完全被水吸收可向试管中缓缓通入V/4 mL氧气,
故答案为:缓缓通入V/4 mL氧气.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,(5)中的计算是本题的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: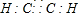 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,不能用水来扑灭,可用CO2灭火 | |
| B. | 钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜 | |
| C. | 钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 | |
| D. | 2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属离子在反应中可能被氧化、也可能被还原 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中存在非极性键 | |
| B. | Na2O2属于电解质,而Cl2、SO2均属于非电解质 | |
| C. | Na2O2与SO2反应和Na2O2与CO2反应完全相同 | |
| D. | 将等物质的量Cl2和SO2同时通入品红溶液,溶液褪色更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com