
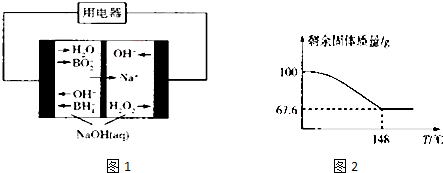
���� ��1��������Һ�й�����������������������Ȼ�����Ϊ�Ȼ������������ⱻ��ԭΪˮ��
��2��������Ŀ��Ϣ��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵�������˳�����
��3����ͼ1�����������������һ�����������������ڵ�һ����������ԭ��Ӧ����һ�۵����õ��������������ӣ���ˮ��ϳ����������ӣ�����������ԭ��Ӧ��ע���Ǽ��Խ��ʣ�
��4�����ݻ�ѧ����ʽ�й�������������������x��ֵ��ȷ����ѧʽ��
��� �⣺��1������������H2O2�����Ȼ����������Ȼ�����ˮ����Ӧ�����ӷ���ʽΪ��H2O2+2Fe2++2H+�T2Fe3++2H2O���ʴ�Ϊ��H2O2+2Fe2++2H+�T2Fe3++2H2O��
��2��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵�����������ᱵ����������ѡ��BaO2���ʴ�Ϊ��BaO2��
��3����ͼ�����������������һ�����������������ڵ�һ����������ԭ��Ӧ����һ�۵����õ��������������ӣ���ˮ��ϳ����������ӣ���H2O2+2e-=2OH-��
�ʴ�Ϊ��H2O2+2e-=2OH-��
��4��2Na2CO3•xH2O2$\frac{\underline{\;\;��\;\;}}{\;}$2Na2CO3+xO2��+2xH2O�������¶ȺͲ�������������������ʾ��ͼ�����¶�Ϊ148��ʱ�����Ĺ���ֻ��̼���ƣ���������Ϊ67.6%�����Թ����������ٵİٷ���Ϊ$\frac{68x}{212+68x}$��100%=1-67.6%�����x=1.5����ѧʽΪNa2CO3•1.5H2O2���ʴ�Ϊ��Na2CO3•1.5H2O2��
���� ���⿼����������ԭ��Ӧ�IJ����жϣ�ԭ��ط�Ӧ�ĵ缫��Ӧ��д���������ʵ�����Ӧ�ã����ʲⶨ��ʵ��̽�����̺ͼ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ֱ��������������3��̼ԭ�Ӳ���һ��ֱ���� | |
| B�� | �ڹ����������ܹ�����������ȡ����Ӧ | |
| C�� | ����ȶ�����Һ�� | |
| D�� | 1 mol������ȫȼ������5 mol O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����ӵĵ���ʽ�� | B�� | Ba��OH��2�ĵ���ʽ�� | ||
| C�� | ���Ȼ�̼�ĵ���ʽ�� | D�� | N2�Ľṹʽ����N��N�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢܢ� | C�� | �٢ۢ� | D�� | �ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
�� ��
�� ��
��

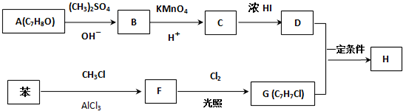
 ����Ӧ����3���õ��Լ�ΪŨHI��
����Ӧ����3���õ��Լ�ΪŨHI���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������NF3����һ����ɫ����ζ�����Ҳ���ȼ�����壬������ͭ�Ĵ���������F2������NH3��Ӧ�õ����÷�Ӧ��һ�ֲ���Ϊ�Σ�
����������NF3����һ����ɫ����ζ�����Ҳ���ȼ�����壬������ͭ�Ĵ���������F2������NH3��Ӧ�õ����÷�Ӧ��һ�ֲ���Ϊ�Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����ҹ���ҵ��ˮƽ�IJ��Ϸ�չ���о�������Ⱦ����ˮ�����������Ϊ��Ҫ���⣮
�����ҹ���ҵ��ˮƽ�IJ��Ϸ�չ���о�������Ⱦ����ˮ�����������Ϊ��Ҫ���⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���ܵ���� | NiS | CuS | Cu��OH��2 | Ni��OH��2 | Fe��OH��3 |
| Ksp�������ȫ��pH | 1.1��10-21 | 1.3��10-36 | pH=9 | pH=9.5 | pH=3.7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com