
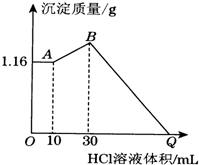
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:分析 向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,
(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子.镁离子全部反应生成氢氧化镁沉淀;
(2)分析可知A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量为:0.02mol×95g/mol=1.90g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)计算得到氢氧化钠物质的量计算得到氢氧化钠的质量;
(4)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时:n(NaOH)=n(HCl).
解答 解:(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O;
(2)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,
故答案为:H2O+AlO2-+H+=Al(OH)3↓;Mg(OH)2、Al(OH)3;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量为:0.02mol×95g/mol=1.90g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质量为:0.13mol×40g/mol=5.20g
故答案为:0.02;5.20;
(4)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时:n(NaOH)=n(HCl),则V(HCl)=$\frac{0.13mol}{1mol/L}$═0.13L=130mL,
故答案为:130.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线变化趋势及每段发生的化学反应为解本题关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生达到分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、乙烯 | B. | 乙烯、乙炔 | C. | 氯乙烯、溴乙烯 | D. | 苯、2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定有化学键断裂,同时也有化学键形成 | |
| B. | 只含共价键的物质一定是共价化合物 | |
| C. | 离子化合物一定含有离子键,可能含有共价键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
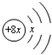 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com