
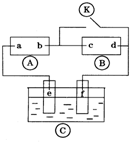
 图
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现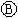 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通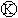 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | f电极为锌板 | ||
| C. | e极发生还原反应 | D. | c极发生的反应为2 H++2e-=H2↑ |
分析 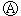 为直流电源,
为直流电源,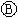 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色,
上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,以此解答该题.
解答 解: 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色,
上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.为实现铁上镀锌,锌作阳极,铁作阴极,所以e电极为锌板,故B错误;
C.e电极是阳极,阳极上失电子发生氧化反应,故C错误;
D.接通K前,c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,则c极发生的反应为2H++2e-═H2↑,故D正确.
故选D.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合应用的考查,题目难度中等,注意把握电极方程式的书写和判断.


科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
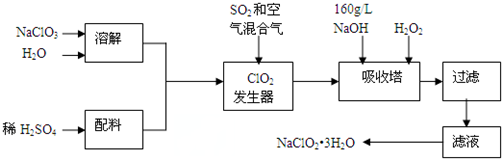
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
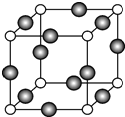 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
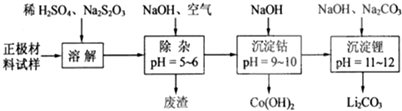
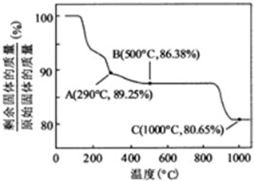
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、NO3-、Cl- | B. | K+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Fe3+、NO3-、SO42- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
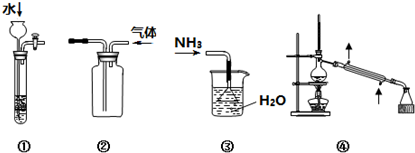
| A. | 装置①关闭活塞,往长颈漏斗中加水,可用于检查该装置的气密性 | |
| B. | 装置②可用于收集NH3、H2等 | |
| C. | 装置③可用于吸收NH3 | |
| D. | 装置④蒸馏时,冷却水从下口进、上口出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com