
| AЃЎ | ЁїH1ЃМЁїH3 | BЃЎ | ЁїH2ЃОЁїH3 | CЃЎ | ЁїH1+ЁїH3=ЁїH2 | DЃЎ | ЁїH1+ЁїH2ЃОЁїH3 |
ЗжЮі ЕЈЗЏШмгкЫЎЪБЃЌШмвКЮТЖШНЕЕЭЃЌИУЗДгІЮЊЮќШШЗДгІЃЌдђЃКCuSO4•5H2OЃЈsЃЉ=Cu2+ЃЈaqЃЉ+SO42-ЃЈaqЃЉ+5H2OЃЈlЃЉЁїH1ЃО0ЃЛ
СђЫсЭШмгкЫЎЃЌШмвКЮТЖШЩ§ИпЃЌЫЕУїИУЗДгІЮЊЗХШШЗДгІЃЌдђЃКCuSO4ЃЈsЃЉ=Cu2+ЃЈaqЃЉ+SO42-ЃЈaqЃЉЁїH2ЃМ0ЃЛ
вбжЊCuSO4•5H2OЃЈsЃЉ=CuSO4ЃЈsЃЉ+5H2OЃЈlЃЉЁїH3ЃЌИљОнИЧЫЙЖЈТЩШЗЖЈИїьЪБфжЎМфЕФЙиЯЕЃЌвдДЫНтД№ИУЬтЃЎ
НтД№ НтЃКЂйЕЈЗЏШмгкЫЎЪБЃЌШмвКЮТЖШНЕЕЭЃЌЗДгІЮЊCuSO4•5H2OЃЈsЃЉ=Cu2+ЃЈaqЃЉ+SO42-ЃЈaqЃЉ+5H2OЃЈlЃЉЁїH1ЃО0ЃЛ
ЂкСђЫсЭШмгкЫЎЃЌШмвКЮТЖШЩ§ИпЃЌИУЗДгІЮЊЗХШШЗДгІЃЌдђЃКCuSO4ЃЈsЃЉ=Cu2+ЃЈaqЃЉ+SO42-ЃЈaqЃЉЁїH2ЃМ0ЃЛ
ЂлвбжЊCuSO4•5H2OЃЈsЃЉ=CuSO4ЃЈsЃЉ+5H2OЃЈlЃЉЁїH3ЃЛ
вРОнИЧЫЙЖЈТЩЂй-ЂкЕУЕНЂлЃКЁїH3=ЁїH1-ЁїH2ЃЌгЩгкЁїH2ЃМ0ЃЌЁїH1ЃО0ЃЌдђЁїH3ЃО0ЃЌ
AЃЎЗжЮіПЩжЊЁїH3ЃО0ЃЌЖјЁїH2ЃМ0ЃЌдђЁїH3ЃОЁїH1ЃЌЙЪAе§ШЗЃЛ
BЃЎЩЯЪіЗжЮіПЩжЊЃКЁїH2ЃМ0ЃЌЁїH1ЃО0ЃЌдђЁїH2ЃМЁїH3ЃЌЙЪBДэЮѓЃЛ
CЃЎЁїH3=ЁїH1-ЁїH2ЃЌдђЁїH1=ЁїH3+ЁїH2ЃЌЙЪCДэЮѓЃЛ
DЃЎЁїH2ЃМ0ЃЌЁїH1ЃО0ЃЌЧвЁїH1=ЁїH3+ЁїH2ЃЌдђЁїH3ЃОЁїH1+ЁїH2ЃЌЙЪDДэЮѓЃЛ
ЙЪбЁAЃЎ
ЕуЦР БОЬтПМВщЛЏбЇЗДгІгыФмСПБфЛЏЃЌЮЊИпЦЕПМЕуЃЌВржиПМВщИЧЫЙЖЈТЩдкШШЛЏбЇЗНГЬЪНМЦЫужаЕФгІгУЃЌЬтФПФбЖШжаЕШЃЌИљОнИЧЫЙЖЈТЩЗжЮіЮяжЪШмНтЙ§ГЬжаЕФФмСПБфЛЏЪЧНтЬтЙиМќЃЌзЂвтУїШЗИЧЫЙЖЈТЩЕФФкШнМАШШЛЏбЇЗНГЬЪНЕФЪщаДддђЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЪЕбщЬт
 NaCNЮЊОчЖОЮоЛњЮяЃЎФГЛЏбЇаЫШЄаЁзщВщдФзЪСЯЕУжЊЃЌЪЕбщЪвРяЕФЧшЛЏФЦШмвКПЩЪЙгУСђДњСђЫсФЦШмвКНјааЭГвЛНтЖОЯњЛйЃЌЫћУЧПЊеЙСЫвдЯТШ§ИіЪЕбщЃЌИљОнвЊЧѓЛиД№ЮЪЬтЃК
NaCNЮЊОчЖОЮоЛњЮяЃЎФГЛЏбЇаЫШЄаЁзщВщдФзЪСЯЕУжЊЃЌЪЕбщЪвРяЕФЧшЛЏФЦШмвКПЩЪЙгУСђДњСђЫсФЦШмвКНјааЭГвЛНтЖОЯњЛйЃЌЫћУЧПЊеЙСЫвдЯТШ§ИіЪЕбщЃЌИљОнвЊЧѓЛиД№ЮЪЬтЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКМЦЫуЬт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЪЕбщЬт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКбЁдёЬт
| AЃЎ | 5.04g | BЃЎ | 3.6g | CЃЎ | 6.48g | DЃЎ | 3.24g |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКНтД№Ьт
| ЪБМфЃЈSЃЉ | 0 | 20 | 40 | 60 | 80 | 100 |
| nЃЈN2O4ЃЉ mol | 0.200 | c1 | 0.10 | c3 | a | b |
| nЃЈNO2ЃЉ mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКНтД№Ьт
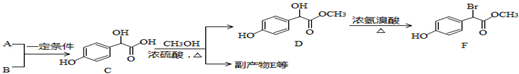
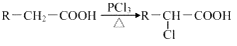
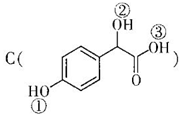 жаЂйЁЂЂкЁЂЂл3Иі-OHЕФЫсадгаЧПЕНШѕЕФЫГ
жаЂйЁЂЂкЁЂЂл3Иі-OHЕФЫсадгаЧПЕНШѕЕФЫГ 

ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com