
分析 ①氧化铝是两性氧化物,能和氢氧化钠反应,而Fe2O3则不能;
②碳酸钠与水、二氧化碳反应生成碳酸氢钠;
③HCl极易溶于水,食盐水抑制氯气的溶解;
④氧化铁与盐酸反应,而二氧化硅不反应.
解答 解:①氧化铝是两性氧化物,能和氢氧化钠反应,而Fe2O3则不能,则选择试剂为NaOH溶液,然后过滤可除杂,故答案为:NaOH溶液;
②碳酸钠与水、二氧化碳反应生成碳酸氢钠,则选择试剂为足量二氧化碳,故答案为:足量二氧化碳;
③HCl极易溶于水,食盐水抑制氯气的溶解,则选择试剂为饱和食盐水,故答案为:饱和食盐水;
④氧化铁与盐酸反应,而二氧化硅不反应,则选择试剂为盐酸,故答案为:盐酸.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物的应用,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
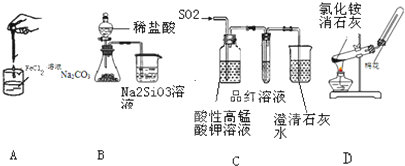
| A. | 制备氢氧化亚铁 | B. | 验证非金属性Cl>C>Si | ||
| C. | 检验二氧化硫中是否混有二氧化碳 | D. | 实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3稀盐酸 | B. | Na2CO3 稀盐酸 | C. | Na2CO3稀硫酸 | D. | NaOH 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
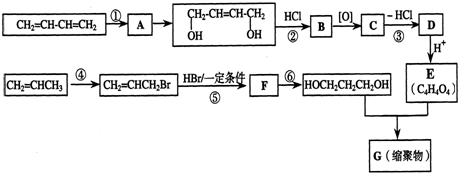
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃 | B. | 不能在空气中燃烧 | ||
| C. | 常温下呈固态 | D. | 可能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
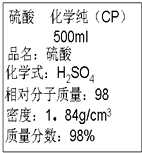
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com