
| A. | 14 g乙烯气体中的氢原子数约为2×6.02×1023 | |
| B. | 标准状况下,2.24 L H2O含有的共价键数约为0.2×6.02×1023 | |
| C. | 1 mol N2与3 mol H2反应生成的NH3分子数约为2×6.02×1023 | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数约为0.05×6.02×1023 |
分析 A.计算乙烯物质的量,1个乙烯分子中含氢原子4个;
B.标准状况下气体摩尔体积为22.4L/mol;
C.氮气和氢气反应为可逆反应不能进行彻底;
D.醋酸为弱酸存在电离平衡.
解答 解:A.14 g乙烯气体物质的量=$\frac{14g}{28g/mol}$=0.5mol,0.5mol乙烯中的氢原子数约为2×6.02×1023,故A正确;
B.标准状况下,水不是气体,2.24 L H2O物质的量不是0.1nol,故B错误;
C.1 mol N2与3 mol H2反应生成的NH3分子,反应为可逆反应,生成氨气分子数小于2×6.02×1023,故C错误;
D.0.1 L 0.5 mol/L CH3COOH溶液中溶质物质的量=0.1 L×0.5 mol/L=0.05mol,溶液中醋酸不能完全电离,含有的氢离子数小于0.05×6.02×1023,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算和判断,熟练掌握公式的使用和物质的结构是解题的关键,注意标况下的气体摩尔体积使用条件和适用对象,注意氧化还原反应电子得失数目的计算,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
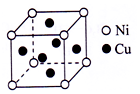 苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.
苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g铁粉与酸反应失去的电子数是NA | |
| B. | 标准状况下,11.2 L NH3含有的原子总数为1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的数目为NA | |
| D. | 46 g N02和N2O4的混合气体含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2的电子式: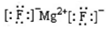 | |
| B. | 中子数为15的硅原子:${\;}_{14}^{29}$Si | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | NH3•H2O 的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO 3-═3Fe 3++2H2O+NO↑ | |
| B. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 固体氯化钠与浓硫酸混合加热:H 2SO 4+2Cl-═SO 2↑+Cl 2↑+H 2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
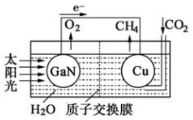 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )| A. | 氮化镓是一种新型无机非金属材料 | |
| B. | 铜电极表面的电极反应式:CO2+8H++8e-═CH4+2H2O | |
| C. | 溶液中H+穿过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸或盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知在常温常压下:
(1)已知在常温常压下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 5:1 | C. | 7:2 | D. | 8:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com