
分析 麻黄碱具有止咳平喘的作用,可用于治疗支气管哮喘,过量服用会产生失眠等副作用;
抗酸药的种类很多,通常含有一种或几种能中和盐酸的化学物质如氢氧化铝;
青霉素是最早发现的对许多病原菌有抑制作用,对人和动物组织无毒的抗生素;
阿司匹林是一种既能解热,又能镇痛,还有消炎、抗风湿作用的药物.
解答 解:①治疗胃酸过多,但患有严重的胃溃疡,应该选择抗酸药(氢氧化铝),故答案为:B;
②可治疗支气管哮喘,但不宜过多服用的药物是麻黄碱,故答案为:A;
③是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是青霉素,故答案为:C;
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是阿司匹林,故答案为:D.
点评 本题考查了药物的使用,明确常见药物的用途及注意事项,题目难度不大.


科目:高中化学 来源: 题型:解答题
 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
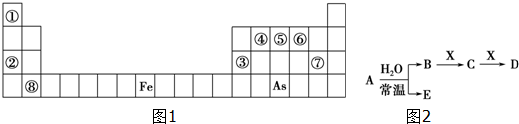
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
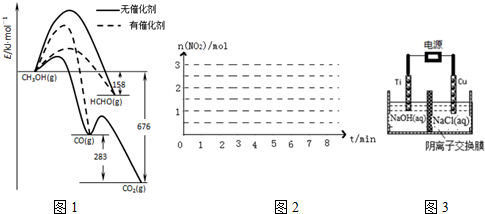
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com