
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:
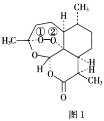
(1)基态O原子的价电子排布图为___。
(2)组成青蒿素的三种元素中电负性最大的是__(填元素符号,下同),第一电离能最大的是__。
(3)基态N原子的未成对电子数为___。
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
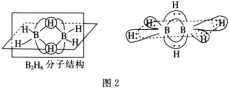
BH4-的空间构型为__;B2H6分子的结构如图2,B2H6中B的杂化方式为__。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__(已知![]() ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
【答案】![]() O O 3 正四面体 sp3 随着n值的增大,聚乙二醇极性越来越弱,水溶性降低 6 0.414
O O 3 正四面体 sp3 随着n值的增大,聚乙二醇极性越来越弱,水溶性降低 6 0.414
【解析】
(1)O元素为8号元素,基态O原子的价电子排布为2s22p4,所以价电子排布图为![]() ;
;
(2)非金属性越强电负性越大,C、H、O三种元素中O元素的非金属性最强,所以电负性最大;H原子最外层只有一个电子,容易失去形成阳离子,第一电离能较小,同周期主族元素自左至右第一电离能呈增大趋势,所以第一电离能O>C>H,即O元素的第一电离能最大;
(3)N元素为7号元素,基态电子排布为1s22s22p3,2p能级有3个未成对电子;
(4)BH4-的中心原子价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体形;根据B2H6分子的结构可知每个B原子价层电子对数为4,所以为sp3杂化;随着n值的增大,聚乙二醇极性越来越弱,水溶性降低;
=4,不含孤电子对,所以空间构型为正四面体形;根据B2H6分子的结构可知每个B原子价层电子对数为4,所以为sp3杂化;随着n值的增大,聚乙二醇极性越来越弱,水溶性降低;
(5)NaH的晶胞与NaCl相同,以体心钠离子为研究对象,与其距离最近的H-位于6个面的面心,所以NaH晶体中阳离子的配位数是6;以晶胞的一个面为例,可以得到如图所示截图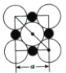 ,则NaH晶体中阴阳离子的最短距离为a的一半即
,则NaH晶体中阴阳离子的最短距离为a的一半即![]() ,阳离子半径为对角线的
,阳离子半径为对角线的![]() ,即为
,即为![]() a,所以阴离子半径为
a,所以阴离子半径为![]() -
-![]() a,则阴、阳离子半径之比为
a,则阴、阳离子半径之比为 =0.414。
=0.414。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如图,其中TBP和P507均为有机萃取剂。
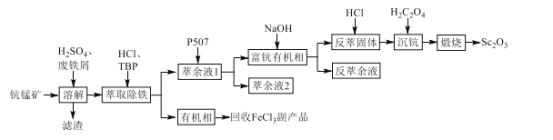
回答下列问题:
(1)Sc2O3中Sc的化合价为___。
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是___。
(3)“滤渣”的主要成分是___。
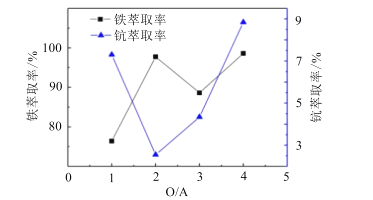
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为___。
(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是___。
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有___。
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是___。
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
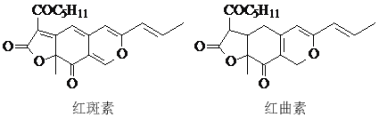
【题目】红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。
下列说法正确的是( )
A.红斑素和红曲素互为同分异构体
B.红斑素和红曲素都能与NaOH溶液反应
C.红斑素中含有醚键、羰基等三种含氧官能团
D.红曲素最多能与6molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
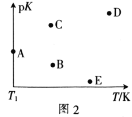
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
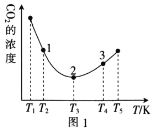
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.乙醛与新制氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
B.向加碘食盐(含碘酸钾)中加入碘化钾溶液和稀硫酸:IO3-+I-+6H+=I2+3H2O
C.偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.亚硫酸钠水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组报用含稀硫酸的KMnO4,溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究"条件对化学反应速率的影响",并设计了如表的方案记录实验结果(忽略溶液混合体积变化),限选试剂和仪器:0.2mol L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
项目 | V(0.2mol L-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol·L-1KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题
(1完成上述反应原理的化学反应方程式____________________________________
(2)上述实验①②是探究___________对化学反应速率的影响;若上述实验②③是探究浓度的对化学反应速率的影响,则a为______;乙是实验需要测量的物理量,则表格中“乙”应填写_______;上述实验②④是探究__________对化学反应速率的影响
(3)已知草酸为二元弱酸,其电离方程式为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com