
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 烧碱 | H2SO4 | BaCO3 | Na2O2 | CO2 |
| B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
| C | 纯碱 | CH3COOH | CaCl2 | Al2O3 | SO2 |
| D | KOH | HClO | CaCO3 | CaO | SiO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 电离时生成的阳离子都是氢离子的化合物是酸,
电离时生成的阴离子都是氢氧根离子的化合物是碱,
由金属离子和酸根离子组成的化合物属于盐,
氧化物是含有两种元素且其中一种元素是氧元素的化合物,碱性氧化物是和酸反应生成盐和水的氧化物,酸性氧化物是和碱反应生成盐和水的氧化物,据此分析.
解答 解:A.烧碱为氢氧化钠属于碱,硫酸为酸,碳酸钡为盐过氧化钠和酸反应生成盐和水、氧气发生的是氧化还原反应,不是碱性氧化物,二氧化碳为酸性氧化物,故A错误;
B.氢氧化钡为碱,氯化氢为酸,氯化钠为盐,氧化钠为碱性氧化物,一氧化碳和碱不反应不是酸性氧化物,故B错误;
C.纯碱为碳酸钠属于盐,醋酸为酸,氯化钙为盐,氧化铝为两性氧化物,二氧化硫为酸性氧化物,故C错误;
D.氢氧化钾为碱,次氯酸为酸,碳酸钙为盐,氧化钙为碱性氧化物,二氧化硅为酸性氧化物,故D正确;
故选D.
点评 本题主要考查盐的概念,解答时要分析各种物质的组成,然后再根据酸、碱、盐、氧化物及其分类概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| W | X | |
| Z |
| A. | 非金属性:W<Z | B. | 简单离子的半径:X2-<Y2+ | ||
| C. | 沸点:H2X<H2Z | D. | WX2的电子式为: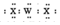 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶解于水且溶解的快,因此可用来做喷泉实验 | |
| B. | 实验室可用氢氧化钠溶液处理含有二氧化硫或氯气的尾气 | |
| C. | 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
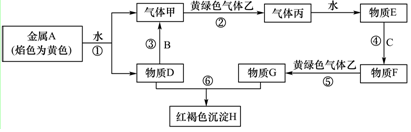
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| D | 闻氯气的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
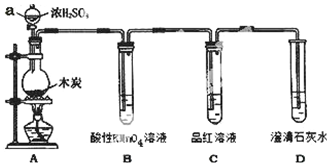 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素的质量比为5:4 | B. | 分子数之比为1:1 | ||
| C. | 原子总数之比为2:3 | D. | 质量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com