
科目:高中化学 来源: 题型:填空题
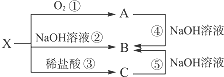 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W | G | |
| A. | 离子半径:T<W<G | |
| B. | 最简单气态氢化物的热稳定性:Q<R | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>G | |
| D. | T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com