
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质,分别设计了如图所示的原电池,请完成下列问题:

(1)①负极材料:
A池________,B池________。
②电极反应式:
A池:正极:________,负极:________
B池:正极:________,负极:________
(2)B池总反应的离子方程式为_________________________________。
(1)①Mg Al ②2H++2e-=H2↑ Mg-2e-=Mg2+ 6H2O+6e-=6OH-+3H2↑ 2Al+8OH--6e-=2AlO2—+4H2O
(2)2Al+2OH-+2H2O=2AlO2—+3H2↑
【解析】原电池中必须有氧化还原反应发生,且负极是发生氧化反应的电极,正极是发生还原反应的电极。A池中:据金属活泼性顺序及电解质溶液为稀硫酸,可判断Mg为该原电池的负极,其电极反应式为Mg-2e-=Mg2+;溶液中的H+在铝极(正极)上获得电子放出H2,其电极反应
式为2H++2e-=H2↑。B池中:因电解质溶液为NaOH溶液,尽管Mg的活泼性比Al强,但Mg与NaOH不反应,而Al能与NaOH发生氧化还原反应,所以B池中Al为负极,其电极反应式为Al+4OH--3e-=AlO2—+2H2O;Mg为正极,其电极反应式为2H2O+2e-=2OH-+H2↑。总电池反应式为2Al+2OH-+2H2O=2AlO2—+3H2↑。


科目:高中化学 来源:2014学年高二鲁科版选修3化学规范训练 1章原子结构练习卷(解析版) 题型:选择题
若短周期的两元素可形成原子个数比为2∶3的化合物,则这两种元素原子序数之差不可能是( )。
A.1 B.3 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.3.2反应限度条件的控制练习卷(解析版) 题型:选择题
可逆反应达到最大反应限度的本质特征是( )。
A.反应停止了 B.正逆反应的速率均为零
C.正逆反应都还在继续进行 D.正逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.2发展中的化学电源练习卷(解析版) 题型:填空题
铅蓄电池是典型的可充电电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.2发展中的化学电源练习卷(解析版) 题型:选择题
如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是( )。

A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.1化学能转化为电能练习卷(解析版) 题型:选择题
根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-=B2+,由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是________。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.1化学能与热能练习卷(解析版) 题型:填空题
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)写出反应的化学方程式: _____________________________。
(2)实验中要立即用玻璃棒迅速搅拌的原因是_____________________________。
(3)如果实验中没有看到“结冰”现象,可能的原因是(答出三个或三个以上原因)__________________________ _____________。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
_______________________________________(答出两种方案)。
(5)“结冰”现象说明该反应是一个________(填“放出”或“吸收”)能量的反应。即断开旧化学键________(填“吸收”或“放出”)的能量________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
(6)该反应在常温下就可进行,说明_________________________________。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1章物质结构 元素周期律练习卷(解析版) 题型:填空题
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的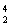 He、
He、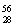 Ni、
Ni、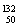 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号__________________。
(2)已知氧有三种同位素 O、
O、 O、
O、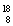 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算, R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性 R__________
R__________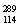 R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.2.2元素周期表周期律的练习卷(解析版) 题型:选择题
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78 ℃,沸点高达2 403 ℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 ℃。由此判断下列有关镓的性质及其用途的叙述不正确的是( )。
A.镓是制造高温温度计的上佳材料
B.镓能溶于强酸和强碱中
C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com