
| A. | H2SO4溶于水能形成H+和SO42-,说明H2SO4是离子化合物 | |
| B. | HCl气体溶于水,HCl分子里共价键被破坏 | |
| C. | 单质分子中不存在化学键,化合物分子中才存在化学键 | |
| D. | 含金属元素的离子一定是阳离子 |
分析 A.H2SO4中只含共价键;
B.HCl只含共价键,溶于水发生电离;
C.多原子构成的单质分子中含化学键;
D.含金属元素的离子,可能为阴离子.
解答 解:A.H2SO4中只含共价键,H2SO4溶于水,发生电离,电离出H+和SO42-,故A错误;
B.HCl只含共价键,溶于水发生电离,则HCl气体溶于水,HCl分子里共价键被破坏,故B正确;
C.多原子构成的单质分子中含化学键,如氢气、氧气中存在共价键,故C错误;
D.含金属元素的离子,可能为阴离子,如偏铝酸根离子、高锰酸根离子,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及实例,题目难度不大.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数 |
| CH3COOH | Ki=1.8×10 -5 |
| H2CO3 | Ki1=4.3×10 -7,Ki2=5.6×10 -11 |
| H2S | Ki1=9.1×10 -8,Ki2=1.1×10 -12 |
| H3PO4 | Ki1=7.5×10 -3,Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
| A. | CH3COONa | B. | Na2CO3 | C. | Na2S | D. | Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、K+、Cl-、AlO2- | |
| B. | 0.1mol•L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、H+、I-、SO42- | |
| D. | 澄清透明的溶液中:Cu2+、SO42-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
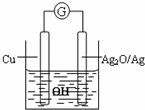 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )| A. | 外电路上,电子由Cu电极沿导线流入Ag2O电极 | |
| B. | 测量原理示意图中,Ag2O为负极 | |
| C. | 负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O | |
| D. | 电池工作时,OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
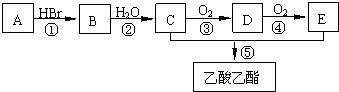
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下体积为10L、pH=13的NaOH溶液中含有Na+的数目为NA | |
| B. | 常温常压下,17g氨气中含有氢原子的数目为NA | |
| C. | 电解水时,阳极生成11.2L气体,则电路中通过的电子数为2NA | |
| D. | 体积为1L、物质的量浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中:Na+、K+、SiO32-、CO32- | |
| B. | pH=13的溶液:Ba2+、Na+、I-、ClO- | |
| C. | 苯酚钠溶液中:HSO3-、K+、Na+、AlO2- | |
| D. | 加入淀粉碘化钾溶液显蓝色:Na+、NH4+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com