
分析 依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$结合1个氢氧根离子含有9个质子,10个电子,质量相等的氢氧根离子和氨气的关系为:OH-~~NH3据此解答.
解答 解:3.01×1023个OH-的物质的量:n=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol;1个氢氧根离子含有9个质子,10个电子,则0.5mol氢氧根离子电子的物质的量为0.5mol×10=5mol,电子数为5NA;0.5molNH3的质量相同,则体积为:0.5mol×22.4L/mol=11.2L;
依据N=n×NA,可知要想与0.5mol氢氧根离子含有离子数相等,则钠离子的物质的量为0.5mol,质量m(Na+)=0.5mol×23g/mol=11.5g;
故答案为:0.5;5NA;11.2;11.5.
点评 本题考查了物质的量的相关计算,明确以物质的量为核心的计算公式,熟悉物质的结构特点即可解答,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:实验题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HI>HBr>HCl>HF | B. | 碱性:Be(OH)2<Mg(OH)2<KOH | ||
| C. | 氧化性:S<O2<F2 | D. | 还原性:O2-<S2-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度NaCN、Na2CO3溶液,pH值:前者>后者 | |
| B. | NaCN溶液中通入少量CO2的离子方程式:2CN-+CO2+H2O=CO32-+2HCN | |
| C. | pH=12的NaOH溶液与pH=5HCN溶液等体积混合后恰好中和,混合后c(Na+)=c(CN-) | |
| D. | 若pH=12的NaOH溶液与pH=5HCN溶液混合后pH=7,则由水电离c(H+)=10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
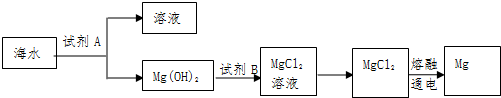
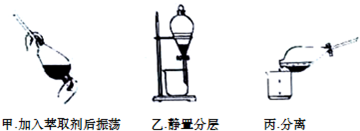
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com