【答案】
分析:(1)根据过滤实验用到的仪器来回答;
(2)可以通过检验溶液中是否含有硫酸根离子来确定氯化钡是否过量;
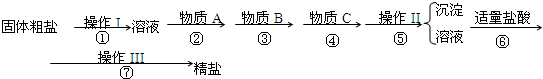
(3)除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
(4)氢氧化镁、碳酸钙、碳酸钡等均会溶解于盐酸中;
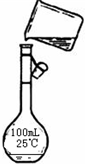
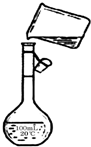
(5)根据配制一定物质的量浓度溶液的方法步骤以及容量瓶的使用原则来回答;
(6)根据公式c=
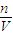
中n和V的影响情况来确定误差.
解答:解:(1)实现沉淀和溶液分离的方法是过滤,用到的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:漏斗;玻璃棒;
(2)向溶液中加入氯化钡,是为了除去硫酸根离子,如果氯化钡过量,则硫酸根离子已经除净,反之回升逾硫酸根,可以在②步后的上层清液中,再滴入氯化钡溶液,若溶液未变浑浊,则说明所加的氯化钡已过量,
故答案为:在②步后的上层清液中,再滴入氯化钡溶液,若溶液未变浑浊,则说明所加的氯化钡已过量;
(3)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:NaOH、BaCl
2、Na
2CO
3或BaCl
2、NaOH、Na
2CO
3,
故答案为:NaOH、BaCl
2、Na
2CO
3或BaCl
2、NaOH、Na
2CO
3;
(4)若先用盐酸调pH值再过滤,这样生成的氢氧化镁、碳酸钙、碳酸钡等均会溶解于盐酸中,影响精盐的纯度,
故答案为:在此酸度条件下,会有部分沉淀溶解,影响精盐的纯度;
(5)配制200mL 1mol/L NaCl(精盐)溶液在移液这一步中,为防止液体外溅,一定要用玻璃棒引流,配制200mL的溶液应选用200mL的容量瓶,故答案为:未用玻璃棒引流,未使用200mL的容量瓶;
(6)A.称量时,托盘天平左盘加砝码,右盘加氯化钠,则实际称得的氯化钠质量是砝码减游码质量,氯化钠的物质的量偏低,故实验结果偏低,故A正确;
B.移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果,故B错误;
C.定容时,俯视容量瓶刻度线观察液面,则溶液的体积不足200mL,所以浓度偏高,故C错误;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,相当于把溶液稀释了,故结果偏低,故D正确.
故选AD.
点评:本题考查学生粗盐提纯实验以及配制一定物质的量浓度溶液实验,要求学生熟记教材知识,掌握基本实验技能,熟练运用.

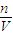 中n和V的影响情况来确定误差.
中n和V的影响情况来确定误差.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案

 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):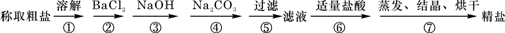

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液