


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:单选题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
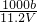
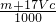
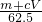
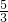 )m<p<(
)m<p<(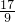 )m
)m查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
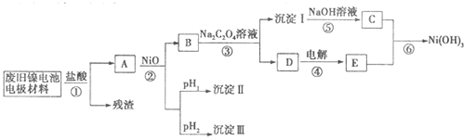
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com