
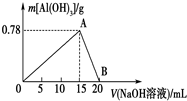
 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:分析 (1)A点生成氢氧化铝沉淀的质量最大;
(2)B点氢氧化铝完全溶解,得到偏铝酸钠溶液;
(3)氢氧化铝与足量的氢氧化钠反应,最终得到偏铝酸钠;
(4)所得Al(OH)3沉淀0.39g<沉淀最大量0.78g,故有两种情况,一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,结合方程式计算解答.
解答 解:(1)由图象可知,0~A发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,图中A点表示的意义是:生成Al(OH)3沉淀的最大值,
故答案为:生成Al(OH)3沉淀的最大值;
(2)由图象可知A~B发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解,B表示的意义为:Al(OH)3沉淀完全溶解于NaOH溶液中,得到NaAlO2溶液,
故答案为:Al(OH)3沉淀完全溶解于NaOH溶液中,得到NaAlO2溶液;
(3)上述两步反应用总的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(4)所得Al(OH)3沉淀0.39g<沉淀最大量0.78g,故有两种情况,一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,
生成Al(OH)3沉淀0.39g,其物质的量为$\frac{0.39g}{78g/mol}$=0.005mol,而氢氧化铝最大量为$\frac{0.78g}{78g/mol}$=0.01mol,
①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,则消耗NaOH为0.005mol×3=0.015mol,此时用去NaOH溶液体积为$\frac{0.015mol}{2mol/L}$=0.0075L=7.5mL,
②发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,消耗NaOH为0.01mol×3=0.03mol,发生Al(OH)3+NaOH═NaAlO2+2H2O,溶解0.005mol氢氧化铝消耗NaOH为0.005mol,故共消耗NaOH为0.035mol,则此时消耗NaOH溶液体积为$\frac{0.035mol}{2mol/L}$=0.0175L=17.5mL,
故答案为:7.5mL或17.5mL.
点评 本题以化学图象为载体,考查化学方程式有关计算,关键是明确各阶段发生的反应,侧重考查学生分析计算能力、对图象的解读能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H4O4 | B. | CO | C. | C6H12O6 | D. | C12H22O11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
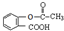 )是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下:
)是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下: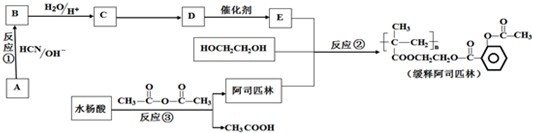
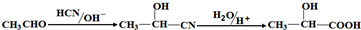
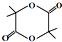 ;;聚合物
;;聚合物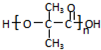 .
.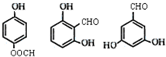 任意2种.
任意2种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com