


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
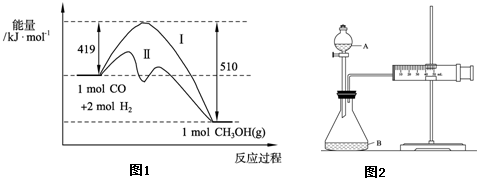
查看答案和解析>>
科目:高中化学 来源: 题型:
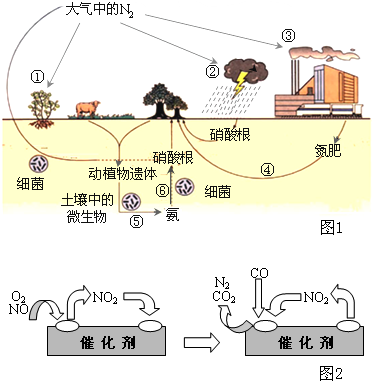 氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①可表示温度对“A2(g)+3B2(g)?2AB3(g)△H<0”的影响 | B、图①可表示压强对2A(g)+2B(g)?3C(g)+D(s)的影响 | C、图②可表示醋酸溶液中通入氨气至过量,溶液导电性的变化 | D、图②可表示Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关影响化学反应速率的因素的说法错误的是
A.影响化学反应速率的主要因素是内因,即反应物本身的性质
B.增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多
C.升高温度可以增大活化分子百分数,也可以增大分子碰撞的频率
D.在其他条件不变时,增大反应物浓度,反应物中的活化分子百分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com