
【题目】将2.7g铝粉分别与体积为100mL、浓度均为2mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)大小比较正确的是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
【答案】B
【解析】
n(Al)=![]() =0.1mol,n(H2SO4)=n(NaOH)=n(HCl)=2mol/L×0.1L=0.2mol;根据2Al~3H2SO4~3H2知,Al完全反应需要n(H2SO4)=0.15mol<0.2mol,则V(H2)=
=0.1mol,n(H2SO4)=n(NaOH)=n(HCl)=2mol/L×0.1L=0.2mol;根据2Al~3H2SO4~3H2知,Al完全反应需要n(H2SO4)=0.15mol<0.2mol,则V(H2)=![]() ×3×22.4L/mol=3.36L;根据2Al~2NaOH~3H2知,Al完全反应需要n(NaOH)=0.1mol<0.2mol,则V(H2)=
×3×22.4L/mol=3.36L;根据2Al~2NaOH~3H2知,Al完全反应需要n(NaOH)=0.1mol<0.2mol,则V(H2)=![]() ×3×22.4L/mol=3.36L;根据2Al~6HCl~3H2知,Al完全反应需要n(HCl)=0.3mol>0.2mol,则盐酸不足量,
×3×22.4L/mol=3.36L;根据2Al~6HCl~3H2知,Al完全反应需要n(HCl)=0.3mol>0.2mol,则盐酸不足量,![]() ×3×22.4L/mol=2.24L,所以①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积关系(相同条件)是①=②>③,故答案为B。
×3×22.4L/mol=2.24L,所以①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积关系(相同条件)是①=②>③,故答案为B。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】准确称取6.00克铝土矿样品(含Al2O3、Fe2O3、SiO2),将其放入盛有100毫升H2SO4溶液的烧杯中,充分反应后滤出沉淀物。在滤液X中加入10摩/升的NaOH溶液,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
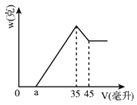
(1)分析图象可知滤液X中所含有的溶质成分为_____(填化学式)。
(2)H2SO4溶液的物质的量浓度是__________?
(3)图中a值为2.3毫升时,铝土矿样品中Fe2O3的质量分数_________________。
(4)a值的变化范围是____________________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)反应开始至2min,以气体Z表示的平均反应速率为_________.
(2)该反应的化学方程式为_________.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
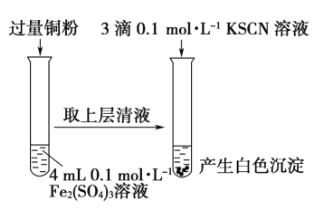
实验Ⅰ:将![]() 转化为
转化为![]()
查阅资料:
已知:①![]() 的化学性质与
的化学性质与![]() 相似
相似
②![]()
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:![]() (棕色)
(棕色)
下列说法不正确的是
A.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
B.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
C.![]() 与
与![]() 反应的离子方程式为
反应的离子方程式为![]()
D.产生![]() 的原因:
的原因:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生。流程如下(部分物质有省略):
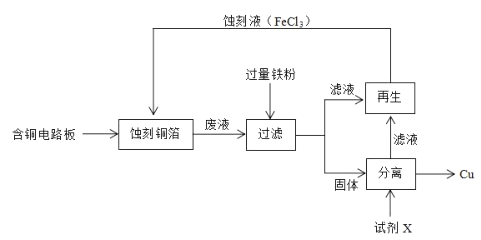
回答下列问题:
(1)氯化铁溶液蚀刻铜箔反应的离子方程式为_______________________________________。
(2)从固体中分离出铜,加入的试剂X可以是________________。
(3)使滤液再生为蚀刻液可采用的方法是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO(s)
MgO(s)
B.H2SO4(浓)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(s)
Fe(s)
D.SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Deacon法制备Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。如图为恒容容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系。下列说法正确的是( )
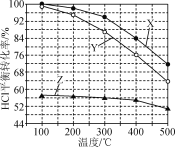
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B.Z曲线对应进料浓度比c(HCl)∶c(O2)=7∶1
C.400 ℃,进料浓度比c(HCl)∶c(O2)=4∶1时,O2平衡转化率为19%
D.400 ℃,进料浓度比c(HCl)∶c(O2)=1∶1时,c起始(HCl)=c0 mol·L-1,平衡常数K=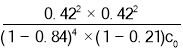
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,化学性质活泼。
(1)在通常情况下,金属铝制品能稳定地存在,不被氧化且不跟水作用,是因为______
(2)将在空气中长时间放置的铝条浸入6mol/L的氢氧化钠溶液中,发现刚开始没有气泡,后来出现大量气泡。出现这一现象的原因是(用文字和方程式表述)____________
(3)明矾是常见的净水剂,写出明矾净水的原因(用文字和方程式表述)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液![]() 中,逐滴加入
中,逐滴加入![]() 的氢氧化钠溶液,所加氢氧化钠溶液的体积(
的氢氧化钠溶液,所加氢氧化钠溶液的体积(![]() )与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
)与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
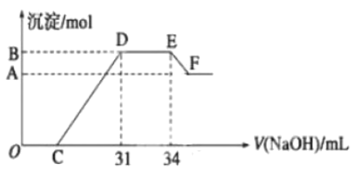
A.溶液![]() 中所含的阳离子有:
中所含的阳离子有:![]() 、
、![]() 、
、![]() 、
、![]()
B.在![]() 段,发生反应的离子方程式为
段,发生反应的离子方程式为![]()
C.无法求出![]() 点对应的沉淀的物质的量
点对应的沉淀的物质的量
D.![]() 点对应的氢氧化钠溶液的体积为
点对应的氢氧化钠溶液的体积为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com