
【题目】随原子序数的递增,九种短周期元素![]() 用字母表示
用字母表示![]() 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示.

请回答下列问题;
![]() 、d、e、f四种元素的简单离子中,半径最大的离子是 ______
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ ![]() 填离子符号
填离子符号![]()
![]() 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
![]() 含f元素的两种离子在溶液中不能大量共存的原因是 ______
含f元素的两种离子在溶液中不能大量共存的原因是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
![]() 关于图乙所示转化关系
关于图乙所示转化关系![]() 代表卤素
代表卤素![]() ,下列说法错误的是 ______ 。
,下列说法错误的是 ______ 。
A.![]()
B.![]()
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
![]() 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:![]() 制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 ![]() 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 ![]() 氟单质与水反应制氧气
氟单质与水反应制氧气
![]() ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的![]() ,使含
,使含![]() 的离子的溶液开始产生沉淀的pH为 ______ 。
的离子的溶液开始产生沉淀的pH为 ______ 。
![]() 元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
【答案】![]()
![]()
![]() C D 3
C D 3 ![]()
【解析】
从图中的化合价、原子半径的大小及原子序数,可知a是H元素,b是C元素,c是N元素,d是O元素,y是F元素,e是Na元素,f是Al元素,g是S元素,z是Cl元素,据此来分析题目即可。
![]() 电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:
电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:![]() ,因此半径最大的是
,因此半径最大的是![]() ;
;
![]() 工业上电解食盐水生成氢氧化钠,反应还生成氯气与氢气,离子方程式为:
工业上电解食盐水生成氢氧化钠,反应还生成氯气与氢气,离子方程式为:![]() ;
;
![]() 含f的两种离子为
含f的两种离子为![]() 、
、![]() ,二者在溶液中发生双水解生成
,二者在溶液中发生双水解生成![]() 沉淀而不能大量共存,反应离子方程式为:
沉淀而不能大量共存,反应离子方程式为:![]() ,
,
![]() 化学键断裂需要吸收能量,则
化学键断裂需要吸收能量,则![]() ,故A正确;
,故A正确;
B.根据盖斯定律可知:![]() ,故B正确;
,故B正确;
C.F的非金属性比氯的强,HF更稳定,破坏![]() 化学键需要的能量更多,故C错误;
化学键需要的能量更多,故C错误;
D.F的非金属性比氯的强,氟气与氢气化合比氯气的容易,故D正确.
答案选C;
![]() 通过反应:
通过反应:![]() 制得HOF,该反应中水中O元素化合价升高,水是还原剂;
制得HOF,该反应中水中O元素化合价升高,水是还原剂;
A.钠与水反应制氢气中水作氧化剂,故A错误;
B.过氧化钠与水反应制氧气,水既不是氧化剂也不是还原剂,故B错误;
C.氯气与水反应制次氯酸,水既不是氧化剂也不是还原剂,故C错误;
D.氟单质与水反应制氧气,水是还原剂,故D正确.
答案选D;
![]() 的最高价氧化物的水化物为
的最高价氧化物的水化物为![]() ,
,![]() ,使含
,使含![]() 的离子的溶液开始产生沉淀,则
的离子的溶液开始产生沉淀,则![]() ,则
,则![]() ,则
,则![]() ;
;
![]() 元素e和g组成的简单化合物B为
元素e和g组成的简单化合物B为![]() ,溶液中
,溶液中![]() 水解呈碱性,溶液中氢离子源于
水解呈碱性,溶液中氢离子源于![]() 水解、水的电离,则
水解、水的电离,则![]() ,则溶液中离子浓度大小比较:
,则溶液中离子浓度大小比较:![]() 。
。


科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,![]() 的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是![]()

A.简单离子半径:![]()
B.Y与W形成的化合物分子可能是非极性分子
C.基态原子的第一电离能:![]()
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器内发生某气体体系反应,根据如图填空。
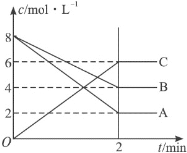
(1)反应物是___,生成物是____。
(2)在2min内A的平均反应速率为___mol·L-1·min-1。
(3)该反应的化学方程式是__![]() ___。
___。
(4)写出此反应的平衡常数表达式___(用物质A、B、C表示),增大压强,平衡向___(填“正”或“逆”)反应方向移动,K___(填“增大”、“减小”或“不变”)。
(5)转化率为已反应的物质的量与初始物质的量比值,B的转化率为___,若升高温度,B的转化率增加,则正反应是___(填“吸热”或“放热”)。
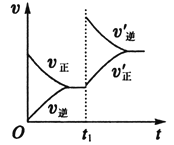
(6)2分钟后的某时刻(t1)改变某一条件使平衡移动,符合如图所示的条件是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4- 、Fe(SCN)3 等。
(1)基态铁原子核外电子排布式为________________.
(2)科学研究表明用 TiO2 作光催化剂可将废水中 CN- 转化为OCN-,并最终氧化为 N2 、CO2。OCN- 中三种元素的第一电离能由大到小的顺序为_________。
(3)与 CN- 互为等电子体的一种分子为________________(填化学式);1mol Fe(CN)63- 中含有![]() 键的数目为________________。
键的数目为________________。
(4)铁的另一种配合物Fe(CO)5 熔点为 —20.5℃,沸点为 103℃,易溶于CCl4,据此可以判断Fe(CO)5 晶体属于________________(填晶体类型)。
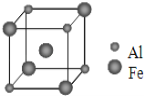
(5)铁铝合金的一种晶体属于体心立方结构,其晶胞可看成由 8 个小体心立方结构堆砌而成。已知小立方体如图所示,该合金的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、M、W的原子序数依次递增,X的简单阴离子与He原子具有相同的电子层结构,Y基态原子未成对电子数在所处周期中最多,M是地壳中含量最多的金属元素,W原子最外层电子数是K层电子数的3倍,Z、W同主族。
(1)下列说法正确的是______。
A.原子半径:![]()
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是______![]() 填元素的符号,下同
填元素的符号,下同![]() ,第一电离能最大的元素是______。
,第一电离能最大的元素是______。
②Z原子的电子排布图![]() 轨道表示式
轨道表示式![]() 为______,W的电子排布式为______。
为______,W的电子排布式为______。
③如图可以表示Y单质分子中电子云重叠方式的是______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
1molY单质分子中含有![]() 键的数目为______。
键的数目为______。
④Y的简单气态氢化物极易溶于水,其原因是______;一种含碳元素的阴离子R与Y的简单气态氢化物互为等电子体,写出R的电子式:______。
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z的非金属性强于W,该反应的离子方程式为______。
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成![]() 。
。
①不考虑空间构型![]() 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示![]() ,
,![]() 的结构可用示意图表示为______。
的结构可用示意图表示为______。
②![]() 的空间构型为______,其M原子轨道的杂化类型为______。
的空间构型为______,其M原子轨道的杂化类型为______。
(4)铁、铜和Y元素可生成晶胞结构图1所示的化合物,该化合物的化学式为______。
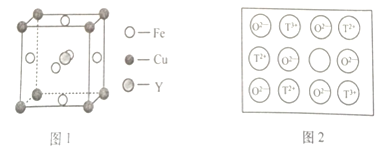
![]() 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷![]() 如图2所示
如图2所示![]() 。
。
①基态![]() 的外围电子排布式为______;若该T的氧化物晶体中每有1个
的外围电子排布式为______;若该T的氧化物晶体中每有1个![]() 空缺,则应有______个
空缺,则应有______个![]() 倍
倍![]() 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。
②若某T的氧化物晶体样品中![]() 与
与![]() 的离子数之比为1:11,则该晶体的化学式为______。
的离子数之比为1:11,则该晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是
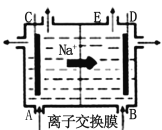
A.从E口逸出的气体是 Cl2
B.每生成 22.4 L Cl2,同时产生2 mol NaOH
C.从B口加入含少量NaOH的水溶液以增强导电性
D.依次用Na2CO3、NaOH、BaCl2、盐酸等试剂除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒浓度关系的叙述错误的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四种溶液的物质的量浓度大小:①>②>③>④
四种溶液的物质的量浓度大小:①>②>③>④
C.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合得溶液中:
的氨水等体积混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3 溶液存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法正确的是()
HCO3-+OH-。下列说法正确的是()
A.加入 NaOH 固体,溶液 pH 减小
B.稀释溶液,水解平衡常数增大
C.升高温度,![]() 减小
减小
D.加入 CaCl2 固体,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答:

(1)反应物是__________;.
(2)2min内A的平均速率是________;
(3)写出化学方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com