
| A. | 体积之比是2:3 | B. | 原子数之比是3:2 | ||
| C. | 质子数之别是1:1 | D. | 物质的量之比是1:1 |
分析 令O2和O3的质量为48g,计算O2和O3的物质的量,进行判断.
A、相同条件下,体积之比等于物质的量之比;
B.气体质量为氧元素质量,氧原子的摩尔质量相同,质量相同氧原子数目相同;
C.每个O原子中含有8个质子;
D、分子数之比等于物质的量之比.
解答 解:令O2和O3的质量为48g,O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,O3的物质的量为1mol.
A.令O2和O3的质量为48g,O2的物质的量为1.5mol,O3的物质的量为1mol,相同条件下,体积之比等于物质的量之比,所以相同质量的O2和O3的体积比为1.5mol:1mol=3:2,故A错误;
B.O2和O3都是氧元素组成的,所以气体质量为氧原子质量,质量相同的O2和O3含有的氧原子为1:1,故B错误;
C.质量相同的O2和O3含有的氧原子相同,每个O原子中含有8个质子,所以质子数之比是1:1,故C正确;
D.令O2和O3的质量为48g,O2的物质的量为1.5mol,O3的物质的量为1mol,所以相同质量的O2和O3的物质的量之比为1.5mol:1mol=3:2,故D错误.
故选C.
点评 本题考查阿伏加德罗定律及其推论,侧重于混合物的计算,注重于学生的分析能力和计算能力的考查,注意从质量守恒的角度解答该题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “碘盐”宜密封保存 | |
| B. | “碘盐”就是“I2+NaCl” | |
| C. | 使用“碘盐”时不宜高温煎炒 | |
| D. | 食用加碘盐,以确保人体对碘的摄入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 | |
| D. | 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S的水解:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
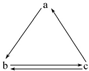 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锰及其化合物有广泛应用.
锰及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与铁粉 | B. | 二氧化碳与石灰水 | ||
| C. | 锌与硫酸 | D. | 碳酸钠与硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com