
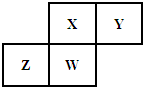
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )| A. | Y元素与氢元素可形成H2Y2型的离子化合物 | |
| B. | Z元素的单质有半导体特性,原子半径:Z>X | |
| C. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4 | |
| D. | 元素Z、W的最高正价分别与其主族序数相等 |
分析 由短周期元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则Y为O元素,可推知X为N元素,Z为Si,W为P元素,结合元素周期律及其单质化合物的性质来解答.
解答 解:由短周期元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则Y为O元素,可推知X为N元素,Z为Si,W为P元素.
A.Y元素与氢元素可形成H2O2属于共价化合物,故A错误;
B.Si单质有半导体特性,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Z>X,故B正确;
C.非金属性N>P,则最高价氧化物对应水化物的酸性:HNO3>H3PO4,故C正确;
D.元素Si、P的最高正价分别为+4、+5,与它们的主族序数相等,故D正确.
故选:A.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表结构与元素周期律,难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
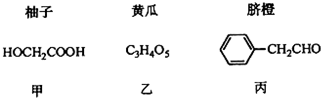
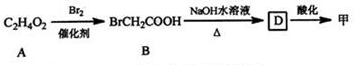
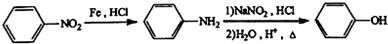
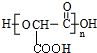 +(n-1)H2O.
+(n-1)H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H+的作用下,溶液中黄色的CrO42-能被氧化为橙红色的Cr2O72- | |
| B. | 7.8 gNa2O2完全反应一定转移了0.1mol电子 | |
| C. | 只用溴水可鉴别出苯、四氯化碳、乙醇、乙醛、环己烯五种无色液体 | |
| D. | 常温下,NH4Cl和NH3•H2O混合的溶液pH一定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)
(标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体B2C3不能从溶液中制得 | |
| B. | C的氧化物对应水化物为强酸 | |
| C. | B的简单离子半径大于D的简单离子半径 | |
| D. | AD2分子中各原子最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子中,原子半径最大的是Z | |
| B. | X、Y形成的化合物能溶于盐酸 | |
| C. | 1 mol W单质与足量X单质反应,转移的电子数为2NA | |
| D. | Z 的最高价氧化物对应水化物的酸性强于Y的最高价氧化物对应水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3俗名纯碱,其水溶液显弱碱性 | |
| B. | 该溶液中K+、Al3+、SO42-可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | AgCl溶于氨水:AgCl+2NH3•H2O=[Ag(NH3)2]++Clˉ+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO3 2- | |
| D. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-=Ag++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com